Аналитические возможности определения аристолохиевой кислоты Ⅰ амперометрическими биосенсорами и поляризационным флуоресцентным иммуноанализом
Аннотация
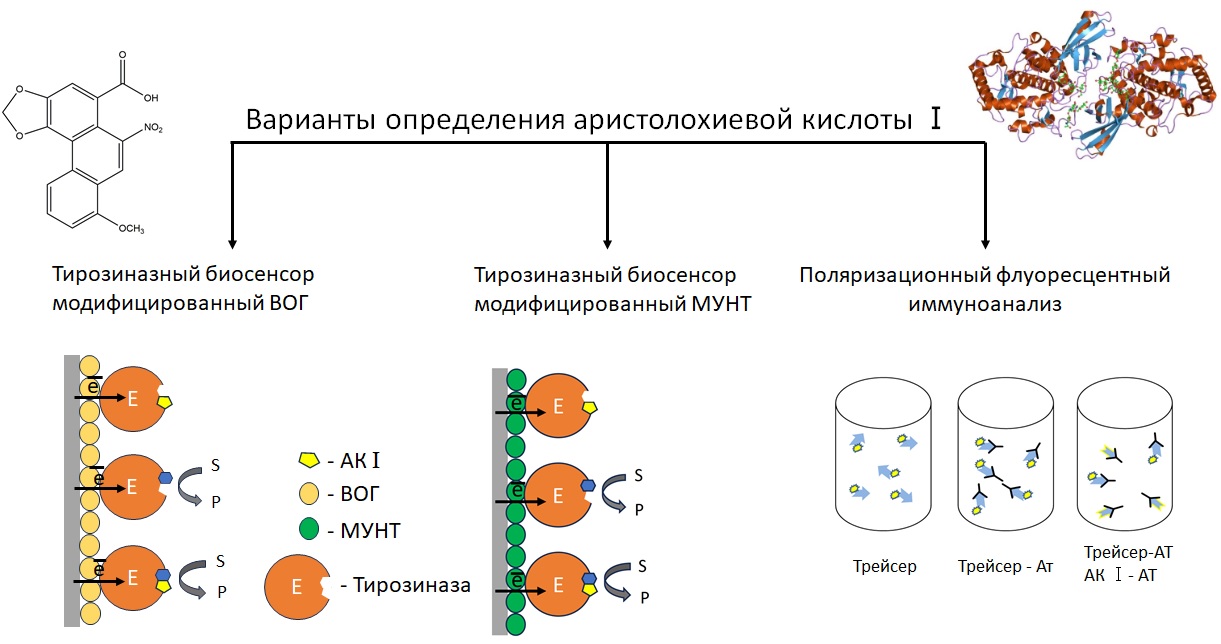
Для определения аристолохиевой кислоты Ⅰ (АК I) разработаны тирозиназные амперометрические биосенсоры на основе графитовых печатных электродов, модифицированых восстановленным оксидом графена (ВОГ), многостенными углеродными нанотрубками (МУНТ) и нанокомпозитом на основе ВОГ и наночастиц серебра (НЧ Ag), а также вариант поляризационного флуоресцентного иммуноанализа (ПФИА) с использованием трейсера на основе флуоресцеин-5(6)-карбоксамидогексановой кислоты. Установлено, что АК Ⅰ является ингибитором тирозиназы в диапазоне концентраций 1×10-10 - 1×10-8 М, нижняя граница определяемых концентраций сн = 7×10-11 М. Модификация поверхности электродов ВОГ и МУНТ позволила улучшить аналитические характеристика биосенсора: диапазон определяемых концентраций составил 1×10-11 - 1×10-6 М для ВОГ и 1×10-10 - 1×10-6 М для МУНТ. Коэффициент корреляции и нижняя граница определяемых концентраций сн на уровне 0.9828 и 8×10-12 М и 0.9859 и 5×10-11 М в случае биосенсоров, модифицированных ВОГ и МУНТ соответственно. Разработан вариант конкурентного поляризационного флуоресцентного иммуноанализа, который позволил определять АК Ⅰ в концентрационном диапазоне 1×10-11 - 1× 10-7 М с сн = 7×10-12 М. Концентрация антител – 1 мг/мл, время инкубации иммунного комплекса трейсер - антитело - 5 мин. Методики определения АК Ⅰ апробированы в образцах травяных сборов, в корнях, листьях и стеблях копытня европейского, а также в сельскохозяйственных культурах, выращенных совместно с копытнем.
Ключевые слова: аристолохиевая кислота Ⅰ, поляризационный флуоресцентный иммуноанализ, копытень европейский, амперометрические биосенсоры, восстановленный оксид графена, многостенные углеродные нанотрубки, наночастицы серебраПолный текст:
PDFЛитература
REFERENCES
Jordan S. A., Perwaiz S. Aristolochic Acids. Encyclopedia of Toxicology (Third Edition), 2014, pp. 298–301.
Shchurevich N.N., Markaryan A.A. [Asarum europeum. Chemical compounds, pharmacological properties and application in medicine]. Vestnik Rossijskogo universiteta druzhby narodov. [Bulletin of the Peoples' Friendship University of Russia, Series: Medicine], 2009, no. 4, pp. 175-179.
Jonge H., Vanrenterghem Y. Aristolochic acid: the common culprit of Chinese herbs nephropathy and Balkan endemic nephropathy. Nephrol. Dial. Transpl., 2008, vol. 23, no. 1, pp. 39-41. doi: 10.1093/ndt/gfm667
Pavlović N.M., Maksimović V., Maksimović J. D., Orem W. H., Tatu C. A., Lerch H. E., Bunnell J. E., Kostić E. N., Szilagyi D. N., Paunescu V. Possible health impacts of naturally occurring uptake of aristolochic acids by maize and cucumber roots: Links to the etiology of endemic (balkan) nephropathy, Environ. Geochem. Hlth., 2013, vol. 35, рр. 215–226. doi: 10.1007/s10653-012-9477-8
Li W., Hu Q., Chan W. Uptake and accumulation of nephrotoxic and carcinogenic aristolochic acids in food crops grown in Aristolochia clematitis-contaminated soil and water, J. Agric. Food Chem., 2016, Vol. 64, рр. 107–112. doi: 10.1021/acs.jafc.5b05089
Chan C., Pavlović N. M., Chan W. Development of a novel liquid chromatography-tandem mass spectrometric method for aristolochic acids detection: Application in food and agricultural soil analyses, Food Chem., 2019, Vol. 289, рр.673–679. doi: 10.1016/j.foodchem.2019.03.073/
Ji H., Zhang G, Zhou X. Rapid simultaneous determination of thirteen aristolochic acids analogs in Aristolochiaceae plants by Ultra-High-Performance liquid Chromatography- tandem mass spectrometry in dynamic multiple reaction monitoring mode, J. Chromatogr. B, 2023, Vol. 1225, 123753. doi: 10.1016/j.jchromb.2023.12375.
Ji F., Jin R., Luo Ch., Den Ch, Hu Ya/, Wang L/. Wang R., Zhang Ji., Song G. Fast determination of aristolochic acid I (AAI) in traditional Chinese medicine soup with magnetic solid-phase extraction by high performance liquid chromatography, J. Chromatogr. A, 2020, vol.1609, 460455. doi: 10.1016/j.chroma.2019.460455.
Chan Ch-K., Pan G., Chan W. Analysis of aristolochic acids in Houttuynia cordata by liquid chromatography–tandem mass spectrometry. J. Mass Spectrom., 2021, vol. 56, issue 4. doi: 10.1002/jms.4652.
Yu X., Gao Yu., Xu Y., Guo X., Guo L., Tan T., Liu F., Wan Y. Study of the Contents of Analogues of Aristolochic Acid in Houttuynia cordata by Ultra-High Performance Liquid Chromatography Tandem Mass Spectrometry. Foods, 2022, vol. 11, issue 3. doi: 10.3390/foods11030302
Meng X., Zhang M., Liu L., Du Ji., Li N., Zou W., Wang C., Chen W., Wei H,, Liu R,, Jia Q., Shao H., Lai Y. Rapid and robust analysis of aristolochic acid I in Chinese medicinal herbal preparations by surface-enhanced Raman spectroscopy/ Spectrochim. Acta A, 2023, vol. 285, 121880. doi: 10.1016/j.saa.2022.121880.
Lin Ch.- Ch., Lin P.- Y., Han Z., Tsai Ch.-Yu., Beck D. E., Hsieh Sh. Rapid identification and detection of aristolochic acids in the herbal extracts by Raman spectroscopy, Spectrochim. Acta A, 2023, vol. 300, 122918. doi.org/10.1016/j.saa.2023.122918
Cheng R., Mao X., Yu J., Liu F., Guo L., Luo D., Wan Y. A dispersive solid-phase extraction method for the determination of Aristolochic acids in Houttuynia cordata based on MIL-101(Fe): An analytes-oriented adsorbent selection design, Food Chem., 2023, vol. 407, 135074. doi:10.1016/j.foodchem.2022.135074
Busy U., Boisseau R., Croyal M., Temgoua R. C. T., Boujtita M. In-line formation and identification of toxic reductive metabolites of aristolochic acid using electrochemistry mass spectrometry coupling. Anal Bioanal Chem, 2022, vol. 414, pp. 2363–2370. doi: 10.1007/s006-022-03874-2.
Wang Y., Qiao M., Baikeli Y., Mamat X., XunHuc L., Dongd Y., Chang F., Zhang H., Hu G. Soft-templated mesoporous carbon-modified glassy carbon electrode for sensitive and selective detection of aristolochic acids. J. Hazard. Mater. 2020, vol. 385, 121550. doi: 10.1016/j.jhazmat.2019.121550.
Chen X., Zhang J., Xie J., Huang Z. Development of two immunochromatographic test strips based on gold nanospheres and gold nanoflowers for the rapid and simultaneous detection of aflatoxin B1 and aristolochic acid a in dual-use medicinal and food ingredients, Microchem. J. 2023, vol. 186, 108307. doi:10.1016/j.microc.2022.108307
Ou A.-F., Chen Z.-J., Zhang Y.-F., He Q.-Y., Xu Z.-L., Zhao S.-Q. Preparation of Anti-Aristolochic Acid I Monoclonal Antibody and Development of Chemiluminescent Immunoassay and Carbon Dot-Based Fluoroimmunoassay for Sensitive Detection of Aristolochic Acid I. Foods. 2021, vol. 10, issue 11, 2647. doi:10.3390/foods10112647.
Bizina E.V., Polosina A.A., Farafonova О. V., Eremin S. А. Ermolaeva Т. N. Opredelenie aristolohievoj kisloty s pomoshch'yu p'ezoelektricheskogo immunosensora na osnove magnitnyh uglerodnyh nanokompozitov. [Determination of aristolochic acid using a piezoelectric immunosensor based on magnetic carbon nanocomposites]. Zavodskaya laboratoriya. Diagnostika materialov [Factory laboratory. Material diagnostics]. 2023, vol. 89, no. 8, pp. 23-30. (in Russian). doi.org/10.26896/1028-6861-2023-89-8-23-30/
Huang C.-L., Wu S.-W., Hsu T.-C., Yang C.-Y., Chung W.-H., Lin X.-J., Liu B.-H., Yu F.-Y.. Novel monoclonal antibody-based sensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for sensitive detecting aristolochic acid I in herbal remedies. Microchem. J. 2023, vol. 191, 108884. doi.org/10.1016/j.microc.2023.108884.
Li Q., Chen H. Synthesis of nanocomposite of bimetal oxide of Ni and Co and multi-wall carbon nanotube modified electrode as a sensitive electrochemical sensor to measure the amount of uric acid in human biological fluid. Int. J. Electrochem. Sci. 2023, vol. 18, issue 8, 100206. doi:doi.org/10.1016/j.ijoes.2023.100206
Brito C. L., Ferreira E. I., La-Scalea M. A. Application of multi-walled carbon nanotubes functionalized with hemin to evaluate the electrochemical behavior of nitrofurazone in aqueous media. Electrochim. Acta. 2023, vol. 459, 142486 doi.org/10.1016/j.electacta.2023.142486
Ziganshin M.A., Safiullina A.S., Gerasimov A.V., Ziganshina S.A., Klimovitskii A.E., Khayarov K.R., Gorbatchuk V.V. Thermally induced self-assembly and cyclization of L-leucyl-L-leucine in solid state. J. Phys. Chem. B. 2017, vol. 121, no. 36, pp. 8603-8610. doi.org/10.1021/acs.jpcb.7b06759.
Ziganshin M.A., Morozova A.S., Ziganshina S.A., Vorobev V.V., Suwińska K., Bukharaev A.A., Gorbatchuk V.V. Additive and antagonistic effects of substrate and vapors on self-assembly of glycyl-glycine in thin films. Mol. Cryst. Liq. Cryst. 2019, vol. 690, no. 1, pp. 67-83. doi.org/10.1080/15421406.2019.1683311.
Beck F., Loessl M., Baeumner A. J. Signaling strategies of silver nanoparticles in optical and electrochemical biosensors: considering their potential for the point-of-care. Microchim. Acta. 2023, vol.190, Article number: 91. doi:10.1007/s00604-023-05666-6
Bejlinson R.M., Yavisheva A.A., Lopatko N.Yu., Medyanceva E.P. Amperometricheskie biosensory dlya opredeleniya tetraciklina. [Amperometric biosensors for the determination of tetracycline]. Zavodskaya laboratoriya. Diagnostika materialov [Factory laboratory. Material diagnostics]. 2022, vol. 88, no. 11, pp. 5-13. (in Russian). doi:10.26896/1028-6861-2022-88-ll-5-13
Mal'ceva L.N., Muhametova L.I., Eremin S.A. Polyarizacionnyj fluorescentnyj immunoanaliz dlya kolichestvennogo opredeleniya organicheskih soedinenij. [Polarization fluorescence immunoassay for quantitative determination of organic compounds]. Laboratory and production, 2020, vol.6 no.15, 78-86 pp. (in Russian). doi: 10.32757/2619-0923.2020.6.15.78.86
Kulis Yu.Yu. Analiticheskie sistemy na osnove immobilizovannyh fermentov [Analytical systems based on immobilized enzymes]. Vilnius: Mokslas., 1981, 200 p. (in Russian).
Zhao Q., Zhuang Q.K. Determination of Phenolic Compounds Based on the Tyrosinase - Single Walled Carbon Nanotubes Sensor, Electroanal. 2005, vol. 17, issue 1, рр. 85–88. doi:10.1002/elan.200403123
Bondarenko A.P., Eremin S.A. Opredelenie mikotoksinov zearalenona i ohratoksina a v zerne metodom polyarizacionnogo fluorescentnogo immunoanaliza. [Determination of mycotoxins zearalenone and ochratoxin a in grain by polarization fluorescence immunoassay]. [J. Analyt. Chem.]. 2012, vol. 67, no. 9, pp. 878-883. (in Russian).
Berezin I.V., Klyosov A.A. Prakticheskij kurs himicheskoj i fermentativnoj kinetiki [Practical course in chemical and enzymatic kinetics]. M.: Science, 1976. 320 p. (in Russian).
Beloglazova N.V., Eremin S.A. Rapid screening of aflatoxin B1 in beer by fluorescence polarization immunoassay. Talanta. 2015, no. 142, рр. 170-175. doi: 10.1016/j.talanta.2015.04.027
DOI: https://doi.org/10.15826/analitika.2023.27.4.004
Ссылки
- На текущий момент ссылки отсутствуют.
