Высокочувствительная иммунохроматография на основе концентрирования аналитов конъюгатами антител и стабилизированных магнитных частиц
Аннотация
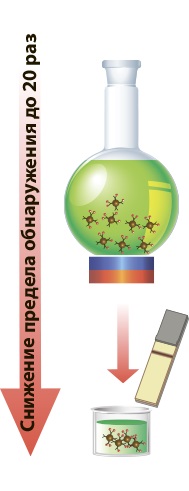
Магнитные частицы (МЧ) с иммобилизованными на их поверхности антителами – эффективный компонент аналитических систем, обеспечивающий селективное связывание контролируемых соединений из больших объемов проб, простое и быстрое концентрирование при наложении внешнего магнитного поля и последующее высокочувствительное выявление. Однако для аналитического применения МЧ необходимо покрытие их поверхности, исключающее агрегацию частиц и неспецифические взаимодействия с ними компонентов проб. В статье представлены результаты исследования, включавшего синтез, модификацию МЧ и их применение в иммунохроматографических тест-системах. МЧ получали, восстанавливая смесь хлоридов железа (II) и (III) аммиаком в различных условиях. В качестве стабилизаторов поверхности использовали олеиновую кислоту, тетраэтоксисилан и его смесь с (3-аминопропил)триэтоксисиланом. Варьируя рН и температуру реакционной среды, соотношения МЧ и стабилизаторов, продолжительность ультразвуковой обработки и последующей инкубации реагентов, получили 20 препаратов поверхностно модифицированных МЧ. Размеры и коллоидную стабильность препаратов характеризовали методами просвечивающей электронной микроскопии и динамического рассеяния света. Выбранные МЧ адсорбционно конъюгировали с антителами к различным низкомолекулярным веществам (антибиотики, гормонально активные соединения) и применяли полученные конъюгаты для концентрирования аналитов из разных объемов проб. Разработаны иммунохроматографические тест-системы, в которых используются ресуспендируемые комплексы (МЧ – антитела – аналит). Предложенное иммуномагнитное концентрирование снизило минимальные выявляемые концентрации аналитов по сравнению с традиционной иммунохроматографией до 20 раз (контроль тетрациклина, предел обнаружения 1.5 нг/мл). Методика объединяет три быстрые стадии – связывание аналита (2 мин), магнитное разделение (2 мин) и иммунохроматографию (от 7 мин), позволяя проводить тестирование без использования стационарного оборудования и с возможностью визуальной оценки результатов.
Ключевые слова: магнитные частицы, иммуносорбенты, концентрирование, иммунохроматография, низкомолекулярные аналиты
Полный текст:
PDFЛитература
REFERENCES
Rodriguez R. S., O’Keefe T. L., Froehlich C., Lewis R. E., Sheldon T. R., Haynes C. L. Sensing food contaminants: advances in analytical methods and techniques. Anal. Chem., 2020, vol. 93, no. 1, pp. 23-40. doi: 10.1021/acs.analchem.0c04357.
Saravanan A., Kumar P. S., Hemavathy R., Jeevanantham S., Kamalesh R., Sneha S., Yaashikaa P. Methods of detection of food-borne pathogens: a review. Environmental Chem. Lett., 2021, vol. 19, pp. 189-207. doi: 10.1007/s10311-020-01072-z.
Domínguez I., Frenich A. G., Romero-González R. Mass spectrometry approaches to ensure food safety. Anal. Methods, 2020, vol. 12, no. 9, pp. 1148-1162. doi: 10.1039/C9AY02681A.
Xu M.-L., Gao Y., Wang X., Han X. X., Zhao B. Comprehensive strategy for sample preparation for the analysis of food contaminants and residues by GC–MS/MS: A review of recent research trend. Foods, 2021, vol. 10, no. 10, article 2473.
Colombo M., Carregal-Romero S., Casula M. F., Gutiérrez L., Morales M. P., Böhm I. B., Heverhagen J. T., Prosperi D., Parak W. J. Biological applications of magnetic nanoparticles. Chem. Society Reviews, 2012, vol. 41, no. 11, pp. 4306-4334. doi: 10.3390/foods10102473.
Stueber D. D., Villanova J., Aponte I., Xiao Z., Colvin V. L. Magnetic nanoparticles in biology and medicine: past, present, and future trends. Pharmaceutics, 2021, vol. 13, no. 7, article 943. doi: 10.3390/pharmaceutics13070943.
Rocha-Santos T. A. Sensors and biosensors based on magnetic nanoparticle. TrAC Trends Anal. Chem., 2014, vol. 62, pp. 28-36. doi: 10.1016/j.trac.2014.06.016.
Urusov A., Petrakova A., Zherdev A., Dzantiev B. Application of magnetic nanoparticles in immunoassay. Nanotechnologies in Russia, 2017, vol. 12, pp. 471-479. doi: 10.1134/S1995078017050135.
Cicek S., Kaba I. Unravelling the potential of magnetic nanoparticles: a comprehensive review of design and applications in analytical chemistr. Anal. Methods, 2024, vol. 16, pp. 3620-3640. doi:10.1039/D4AY00206G.
Ali A., Shah T., Ullah R., Zhou P., Guo M., Ovais M., Tan Z., Rui Y. Review on recent progress in magnetic nanoparticles: Synthesis, characterization, and diverse applications. Frontiers chem., 2021, vol. 9, article 629054. doi: 10.3389/fchem.2021.629054.
Ahangaran F., Navarchian A. H. Recent advances in chemical surface modification of metal oxide nanoparticles with silane coupling agents: A review. Adv. Colloid Interface Sci., 2020, vol. 286, article 102298. doi: 10.1016/j.cis.2020.102298.
Liu P., Wang T., Yang Z., Hong Y., Xie X., Hou Y. Effects of Fe3O4 nanoparticle fabrication and surface modification on Chlorella sp. harvesting efficiency, Science of the Total Environment, 2020, vol. 704, article 135286. doi: 10.1016/j.scitotenv.2019.135286.
Razo S. C., Panferov V. G., Safenkova I. V., Varitsev Y. A., Zherdev A. V., Dzantiev B. B. Double-enhanced lateral flow immunoassay for potato virus X based on a combination of magnetic and gold nanoparticles. Anal. Chim. Acta, 2018, vol. 1007, pp. 50-60. doi: 10.1016/j.aca.2017.12.023.
Panferov V. G., Safenkova I. V., Zherdev A. V., Dzantiev B. B. Post-assay growth of gold nanoparticles as a tool for highly sensitive lateral flow immunoassay. Application to the detection of potato virus X. Microchim. Acta, 2018, vol. 185, pp. 1-8. doi: 10.1007/s00604-018-3052-7.
Petrakova A., Urusov A., Zherdev A., Liu L., Xu C., Dzantiev B. Application of magnetite nanoparticles for the development of highly sensitive immunochromatographic test systems for mycotoxin detection. Appl. Biochem. Microbiol., 2017, vol. 53, pp. 470-475. doi: 10.1134/S0003683817040111.
Berlina A. N., Ragozina M. Y., Komova N. S., Serebrennikova K. V., Zherdev A. V., Dzantiev B. B. Development of lateral flow test-system for the immunoassay of dibutyl phthalate in natural waters. Biosensors, 2022, vol. 12, no. 11, article 1002. doi: 10.3390/bios12111002.
Zvereva E. A., Byzova N. A., Sveshnikov P. G., Zherdev A. V., Dzantiev B. B. Cut-off on demand: adjustment of the threshold level of an immunochromatographic assay for chloramphenicol. Anal. Methods, 2015, vol. 7, no. 15, pp. 6378-6384. doi: 10.1039/C5AY00835B.
Berlina A. N., Komova N. S., Serebrennikova K. V., Zherdev A. V., Dzantiev B. B. Comparison of Conjugates Obtained Using DMSO and DMF as Solvents in the Production of Polyclonal Antibodies and ELISA Development: A Case Study on Bisphenol A. Antibodies, 2024, vol. 13, no. 4, article 89. doi: 10.3390/antib13040089.
Urusov A. E., Petrakova A. V., Vozniak M. V., Zherdev A. V., Dzantiev B. B. Rapid immunoenzyme assay of aflatoxin B1 using magnetic nanoparticles. Sensors, 2014, vol. 14, no. 11, pp. 21843-21857. doi: 10.3390/s141121843.
Hyeon T. Chemical synthesis of magnetic nanoparticles. Chem. Commun., 2003, no. 8, pp. 927-934. doi: 10.1039/B207789B.
Petrakova A., Urusov A., Zherdev A., Dzantiev B. Comparative study of strategies for antibody immobilization onto the surface of magnetic particles in pseudo-homogeneous enzyme immunoassay of aflatoxin B1. Moscow Univer. Chem. Bulletin, 2016, vol. 71, pp. 48-53. doi: 10.3103/S0027131416010119.
Kodama R. Magnetic nanoparticles. J. Magn. Magn. Mater., 1999, vol. 200, no. 1-3, pp. 359-372. doi: 10.1016/S0304-8853(99)00347-9.
Martins P. M., Lima A. C., Ribeiro S., Lanceros-Mendez S., Martins P. Magnetic nanoparticles for biomedical applications: from the soul of the earth to the deep history of ourselves. ACS Appl. Bio Mater., 2021, vol. 4, no. 8, pp. 5839-5870. doi: 10.1021/acsabm.1c00440.
Spicar-Mihalic P. Old But Good: Advances and Strategies in Developing Nitrocellulose-based Flow-through immunoassay. University of Washington, 2010.
Kalska-Szostko B., Wykowska U., Piekut K., Satuła D. Stability of Fe3O4 nanoparticles in various model solutions. Colloids Surf. A: Physicochem. Eng. Aspects, 2014, vol. 450, pp. 15-24. doi: 10.1016/j.colsurfa.2014.03.002.
Doane T. L., Chuang C.-H., Hill R. J., Burda C. Nanoparticle ζ-potentials. Accounts Chem. Res., 2012, vol. 45, no. 3, pp. 317-326. doi: 10.1021/ar200113c.
DOI: https://doi.org/10.15826/analitika.2024.28.4.001
Ссылки
- На текущий момент ссылки отсутствуют.
