ОПРЕДЕЛЕНИЕ ВИДОВОГО СОСТАВА АНТОЦИАНОВ ЦВЕТКОВ Сatharanthus
Аннотация
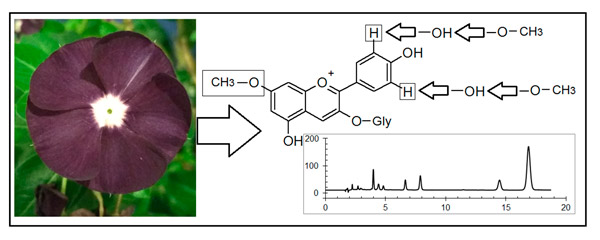
С использованием обращенно-фазовой высокоэффективной жидкостной хроматографии с диодно-матричным и масс-спектрометрическим детектированием исследован видовой состав антоцианов цветков Catharanthus roseum. После кислотного гидролиза антоцианов по характерному изменению электронных спектров поглощения и по изменению удерживания было установлено, что все пять антоцианидинов цветков фиолетового цвета отличаются от пяти наиболее часто встречающихся в природе (в виде гликозидов) антоцианидинов однотипным дополнительным метилированием. Направление метилирования по гидроксильной группе в положении 7 флавилиевого скелета было определено при анализе изменения параметров электронных спектров поглощения; таким образом, антоцианы цветков катарантуса построены на пяти необычных антоцианидинах, – являясь производными 7-метилдельфинидина, 7-метилцианидина, 7-метилпетунидина, 7 метилпеонидина (розинидина) и 7 метилмальвидина (хирсутидина). Сопоставление масс-спектрометрических данных, электронных спектров поглощения и параметров удерживания антоцианов цветков Catharanthus roseum указывают на присутствие в экстрактах лепестках цветков 3-рамозилгалактозидов указанных антоцианидинов, к которым добавляются (в меньшем количестве) 3-галактозиды.
Ключевые слова: антоцианы, 7-метилированные антоцианы, обращенно-фазовая ВЭЖХ
Полный текст:
PDF (Russian)Литература
REFERENCES
Francis F.J. A new group of food colorants. Trends Food Sci. Technol., 1992, vol. 31, pp. 27-30. doi: 10.1016/0924-2244(92)90112-A.
Sipahli S., Mohanlall V., Mellem J.J. Stability and degradation kinetics of crude anthocyanin extracts from H. sabdariffa. Food Sci. Technol., Campinas, 2017, vol. 37, pp. 209-215. doi: 10.1590/1678-457x.14216.
Kähkönen M.P., Heinonen M. Antioxidant activity of anthocyanins and their aglycons. J. Agric. Food Chem., 2003, vol. 51, pp. 628-633. doi: 10.1021/jf025551i.
Piovan A., Filippini R., Favretto D. Characterization of the Anthocyanins of Catharanthus roseus (L.) G. Don In Vivo and In Vitro by Electrospray Ionization Ion Trap Mass Spectrometry. Rapid Commun. Mass Spectrom., 1998, vol. 12, pp. 361–367. doi: 10.1002/(SICI)1097-0231(19980415)12:7<361::AID-RCM162>3.0.CO;2-U
Piovan A., Filippini R. Anthocyanins in Catharanthus roseus in vivo and in vitro: a review. Phytochem. Rev., 2007, vol. 6, pp. 235–242. doi: 10.1007/s11101-006-9052-y.
Dai Y., Rozema E., Verpoorte R., Choi Y.-H. Application of natural deep eutectic solvents to the extraction of anthocyanins from Catharanthus roseus with high extractability and stability replacing conventional organic solvents. J. Chromat. A, 2016, vol. 1434, pp. 50-56. doi: 10.1016/j.chroma.2016.01.037
Toki K., Saito N., Irie Y. Tatsuzawa F., Shigihara A., Honda T. 7-O-Methylated anthocyanidin glycosides from Catharanthus roseus. Phytochem., 2008, vol. 69, pp. 1215-1219. doi: 10.1016/j.phytochem.2007.11.005.
Deineka V.I., Vu Thi Ngoc Anh, Deineka L.A. RP HPLC determination of some uncommon anthocyanins. Sorbtsionnye i khromatograficheskie protsessy [Sorption and chromatographic processes], 2014, vol. 14, no. 3, pp. 360-366. [In Russian]. http://www.sorpchrom.vsu.ru/articles/20140301.pdf.
He F., Mu L., Yan G.-L., Liang N.-N., Pan Q.-H., Wang J., Reeves M.J., Duan C.-Q. Biosynthesis of Anthocyanins and Their Regulation in Colored Grapes. Molecules, 2010, vol. 15, pp. 9057-9091. doi: 10.3390/molecules15129057.
Deineka V.I. [Methylene selectivity of one homologous series in reversed-phase chromatography]. Sorbtsionnye i khromatograficheskie protsessy [Sorption and chromatographic processes], 2007, vol. 7, no. 2, pp. С. 236-243 [In Russian].
Deineka V.I., Deineka L.A., Saenko I.I., Chulkov A.N. A Float Mechanism of Retention in Reversed-Phase Chromatography. Russ. J. Phys. Chem. A, 2015, vol. 89, no. 7, pp. 1300–1304. doi: 10.1134/S0036024415070079.
Harborne J.B. Spectral methods of characterizing anthocyanins. Biochem. J., 1958, vol. 70, pp. 22-28. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1196618/pdf/biochemj00829-0032.pdf.
Anthocyanins. Biosynthesis, functions, and applications / Ed. Gould K., K. Davies, and C. Winefield. Springer Science+Business Media, LLC, New York, NY, USA, 2009. – 336 p. doi: 10.1007/978-0-387-77335-3.
Welch C.R., Wu Q., Simon J.E. Recent Advances in Anthocyanin Analysis and Characterization. Curr. Anal. Chem., 2008, vol. 4, pp. 75–101. doi: 10.2174/157341108784587795
Makarevitch S.L., Chulkov A.N., Deineka V.I., Costenko M.O., Deineka L.А., Tokhtar V.K. [Determination of anthocyanins in fruits of some species of grapes by HPLC]. Sorbtsionnye i khromatograficheskie protsessy [Sorption and chromatographic processes], 2014, vol. 14, no. 6, pp. 1024-1031 [In Russian]. http://www.sorpchrom.vsu.ru/articles/20140617.pdf.
Deineka V.I., Grigor'ev A.M., Staroverov V.M., Borzenko O.N. Incremental Approach to HPLC Analysis of Anthocyans. Chem. Nat. Comp., 2003, vol. 39, no. 2, pp. 182-185. doi: 10.1023/A:1024813914213.
Berardini N., Schieber A., Klaiber I., Beifuss U., Carle R., Conradbet J. 7-O-Methylcyanidin 3-O-β-D-Galactopyranoside, a Novel Anthocyaninfrom Mango (Mangifera indica L. cv. ‘Tommy Atkins’) Peels. Z. Naturforsch., 2005, vol. 60b, pp. 801-804. http://www.znaturforsch.com/ab/v60b/s60b0801.pdf
Deineka V.I., Grigor'ev A.M. Relative analysis of the chromatographic retention of cyanidin glycosides. Russ. J. Phys. Chem., 2004, vol. 78, pp. 796-799.
Ссылки
- На текущий момент ссылки отсутствуют.
