ПОЛИ-4-ВИНИЛПИРИДИНИЕВЫЕ НАНОГУБКИ В КАЧЕСТВЕ МОДИФИКАТОРОВ ЭЛЕКТРОФОРЕТИЧЕСКИХ СИСТЕМ ДЛЯ РАЗДЕЛЕНИЯ ЗАРЯЖЕННЫХ АНАЛИТОВ
Аннотация
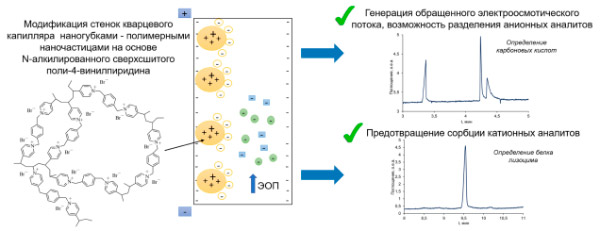
Новые гидрофильные ионные полимерные наночастицы на основе N-алкилированного сверхсшитого поли-4-винилпиридина (наногубки – НГ) имеют пористую структуру, несут рН-независимый положительный заряд и содержат ароматические звенья, что позволяет предполагать возможность формирования покрытий стенок кварцевого капилляра на их основе для разделения анионных и катионных аналитов. В рамках исследования впервые предложены подходы к формированию покрытий на основе наногубок с молекулярной массой 400 и 10 кДа. Показано, что для обеспечения стабильности таких покрытий необходимо введение НГ в состав фонового электролита (ФЭ). Определен рабочий диапазон рН ФЭ (4-9) для последующих электрофоретических экспериментов. Результаты сопоставлены с полученными нами ранее экспериментальными данными по формированию покрытий на основе наноразмерных частиц (НЧ) сшитого полистирола, функционализированных четвертичными аммонийными группами. Для выявления перспектив покрытия на основе НГ с молекулярной массой 400 кДа рассмотрен широкий спектр аналитов: карбоновые кислоты, аминокислоты, антибиотики фторхинолонового ряда, биогенные амины, белки. Разделение карбоновых кислот на таких капиллярах характеризуется иной селективностью по сравнению с капиллярами, покрытыми НЧ, функционализированными четвертичными аммонийными группами. При разделении аминокислот НГ влияют на селективность разделения за счет взаимодействия с аналитами, а в случае антибиотиков НГ выступают только в роли агента, обращающего электроосмотический поток (ЭОП). Установлено, что модификация стенок капилляра НГ с молекулярной массой 400 кДа позволяет предотвращать сорбцию основных аналитов (биогенные амины, белок лизоцим) в процессе их электрофоретического разделения.
Ключевые слова: капиллярный электрофорез, наночастицы, покрытия стенок капилляра
Полный текст:
PDF (Russian)Литература
REFERENCES
Shallan А., Guijt R., Breadmore M. Capillary Electrophoresis: Basic Principles. Encyclopedia of Forensic Sciences, Second Edition, 2013, pp. 549-559. doi: 10.1016/B978-0-12-382165-2.00241-5.
Stutz H. Protein attachment onto silica surfaces - a survey of molecular fundamentals, resulting effects and novel preventive strategies in CE. Electrophoresis, 2009, vol. 30, no. 12, pp. 2032–2061. doi:10.1002/elps.200900015
Bessonova E., Kartsova L., Gallyamova V. Ionic liquids based on imidazole for online concentration of catecholamines in capillary electrophoresis. J. Sep. Sci., 2017, vol. 40, no. 10, pp. 2304–2311. doi:10.1002/jssc.201601394.
Lucy C. A., MacDonald A. M., Gulcev, M. D. Non-covalent capillary coatings for protein separations in capillary electrophoresis. J. Chromatogr. A, 2007, vol. 1184, no. 1-2, pp. 81–105. doi:10.1016/j.chroma.2007.10.114.
Znaleziona J., Petr J., Knob R., Maier V., Sevcik J. Dynamic Coating Agents in CE. Chromatographia, 2008, vol. 67, pp. 5–12. doi:10.1365/s10337-007-0509-y.
Nehme R., Perrin C., Cottet H., Blanchin M-D., Fabre H. Influence of polyelectrolyte capillary coating conditions on protein analysis in CE. Electrophoresis, 2009, vol. 30, pp. 1888–1898. doi: 10.1002/elps.200800688.
Polikarpov N., Potolytsyna V., Bessonova E., Tripp S., Appelhans D., Voit B., Kartsova L. Dendritic glycopolymers as dynamic and covalent coating in capillary electrophoresis: View on protein separation processes and detection of nanogram-scaled albumin in biological samples. J. Chromatogr. A, 2015, vol. 1378, pp. 65–73. doi: 10.1016/j.chroma.2014.11.051.
Dzema D., Kartsova L., Kapizova D., Appelhans D. New approach to the formation of physically adsorbed capillary coatings consisting of hyperbranched poly(ethylene imine) with a maltose shell to enhance the separation of catecholamines and proteins in CE. Chromatographia, 2017, vol. 80, no. 11, pp.1683–1693. doi:10.1007/s10337-017-3390-3.
Zarei M., Ghasemabadi M. Nanoparticle improved separations: From capillary to slab gel electrophoresis. TrAC, 2017, vol. 86, pp. 56-74. doi: 10.1016/j.trac.2016.11.004.
Duan A., Xie S., Yuan L. Nanoparticles as stationary and pseudo-stationary phases in chromatographic and electrochromatographic separations. TrAC, 2011, vol. 30, pp. 484-491. doi: 10.1016/j.trac.2011.01.007.
Beeram S. R., Rodriguez, E., Doddavenkatanna S., Li Z., Pekarek A., Peev D., Goerl K., Trovato G., Hofmann T., Hage D. S. Nanomaterials as stationary phases and supports in liquid chromatography. Electrophoresis, vol. 38, no. 19, pp. 2498–2512. doi:10.1002/elps.201700168.
Xu L., Cui P., Wang D., Tang C., Dong L., Zhang C., Duan H., Yang V. C. Preparation and characterization of lysine-immobilized poly(glycidyl methacrylate) nanoparticle-coated capillary for the separation of amino acids by open tubular capillary electrochromatography. J. Chromatogr. A, vol. 1323, pp. 179–183. doi: 10.1016/j.chroma.2013.10.093.
Hu W., Hong T., Gao X., Ji Y. Applications of nanoparticle-modified stationary phases in capillary electrochromatography. TrAC, 2014, vol. 61, pp. 9-39. doi: 10.1016/j.trac.2014.05.011.
Guo Y., Xu F., Meng L., Tang W., Xia Y., Wu Y., Zhang S. Preparation and application of trimethylamine amination polychloromethyl styrene nanolatex coated capillary column for the determination of bromate by field-amplified sample stacking open-tubular capillary electrochromatography. Electrophoresis, 2013, vol. 34, pp. 1312-1318. doi: 10.1002/elps.201200541.
Hutchinson J. P., Zakaria P., Bowie A. R., Macka M., Avdalovic N., Haddad P. R. Latex-Coated Polymeric Monolithic Ion-Exchange Stationary Phases. 1. Anion-Exchange Capillary Electrochromatography and In-Line Sample Preconcentration in Capillary Electrophoresis. Anal. Chem., 2005, vol. 77, no. 2, pp. 407–416. doi:10.1021/ac048748d
Polikarpova D., Makeeva D., Kartsova L., Dolgonosov A., Kolotilina N. Nano-sized anion-exchangers as a stationary phase in capillary electrochromatography for separation and on-line concentration of carboxylic acids. Talanta, 2018, vol. 188, pp. 744-749. doi: 10.1016/j.talanta.2018.05.094.
Kleindienst G., Huber C., Gjerde D., Yengoyan L., Bonn G. Capillary electrophoresis of peptides and proteins fused-silica capillaries coated with derivatized polystyrene nanoparticles. Electrophoresis, 1998, vol. 19, pp. 262–269. doi: 10.1002/elps.1150190220.
Hajba L., Guttman A. Recent advances in column coatings for capillary electrophoresis of proteins. TrAC, 2017, vol. 90, pp. 38–44. doi: 10.1016/j.trac.2017.02.013.
Hsieh Y.-L., Chen T.-H., Liu C.-P., Liu C.-Y. Titanium dioxide nanoparticles‐coated column for capillary electrochromatographic separation of oligopeptides. Electrophoresis, 2005, vol. 26, pp. 4089–4097. doi: 10.1002/elps.200500462.
Wang W.T., Xiao X., Chen J., Jia L. Carboxyl modified magnetic nanoparticles coated open tubular column for capillary electrochromatographic separation of biomolecules. J. Chromatogr. A, 2015, vol. 1411, pp. 92-100. doi: 10.1016/j.chroma.2015.07.111
Bachmann S., Vallant R., Bakry R., Huck C., Corradini D., Bonn G. CE coupled to MALDI with novel covalently coated capillaries. Electrophoresis, 2010, vol. 31, pp. 618–629. doi: 10.1002/elps.200900507.
Pavlova L.A., Davankov V.A., Timofeeva G.I., Il’in M.M. (jr), Bladodatskih I.V., Sinitsyna O.V., Matveev V.V., Chalykh A.E. [Nanosponges as products of 4 - vinilpyridine and poly-4-vinilpyridines N-alkylation in diluted solutions] // Vysokomolekuliarnye soedineniia, Seriia A [Polymer Science Series A], 2013, vol. 55, no. 10, pp. 1263–1273. doi: 10.7868/S0507547513090067 (in Russian).
Takeuchi T., Kawasaki T., Lim L.W. Separation of inorganic anions on a pyridine stationary phase in ion chromatography. Anal. Sci., 2010, vol. 26, pp. 511-514.
Nagai K., Shibata T., Shinkura S., Ohnishi A. Poly(4-vinylpyridine) based novel stationary phase investigated under supercritical fluid chromatography conditions. J. Chromatogr. A, 2018, vol. 1572, pp. 119–127. doi: 10.1016/j.chroma.2018.08.038.
Maerle K.V., Pavlova L.A., Davankov V.A. [Investigation of properties of monolithic columns based on 4-vinylpyridine and 1,4-bis- (bromomethyl) -benzene in capillary electrochromatography]. Sorbtsionnye i khromatograficheskie protsessy [Sorption and chromatographic processes], 2009, vol. 9, no. 4, pp. 469-476 (in Russian).
Patrushev Y., Yudina Y., Sidelnikov V. Monolithic rod columns for HPLC based on divinylbenzene-styrene copolymer with 1-vinylimidazole and 4-vinylpyridine. J. Liq. Chromatogr. Related Technol., 2018, vol. 41, pp. 458–466. doi:10.1080/10826076.2018.1455149.
He K., Blaney L. Systematic optimization of an SPE with HPLC-FLD method for fluoroquinolone detection in wastewater. J. Hazard. Mater., 2015, vol. 282, pp. 96–105. doi:10.1016/j.jhazmat.2014.08.027.
Ссылки
- На текущий момент ссылки отсутствуют.
