НОВЫЙ ПОДХОД К ХРОМАТОГРАФИЧЕСКОМУ ОПРЕДЕЛЕНИЮ РАСТВОРИМОСТИ КВЕРЦЕТИНА В ВОДЕ
Аннотация
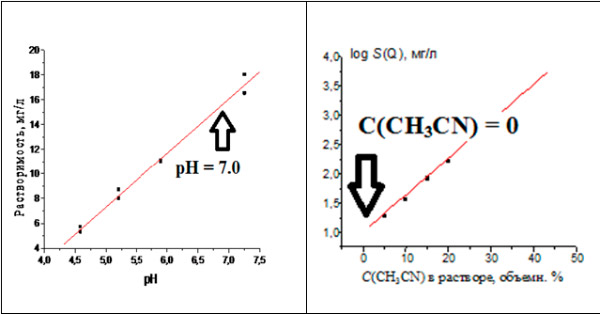
Значительный разброс литературных данных по растворимости кверцетина (Q) в воде при комнатной температуре (более чем в 5000 раз!) заставляет предложить новый подход к определению этой характеристики. Он основан не на единичных определениях, а на выявлении и сопоставлении двух зависимостей растворимости кверцетина. Первая из них – зависимость растворимости от рН водных растворов, S(Q) = a×рН + b, с последующей интерполяцией S(Q) на величину рН = 7, соответствующую чистой воде. Вторая – зависимость растворимости от содержания ацетонитрила в водно-ацетонитрильных растворах, lg S(Q) = a×[CH3CN] + b, с экстраполяцией lg S(Q) на нулевую концентрацию органического растворителя, также соответствующую чистой воде. Для анализа растворов использован метод обращенно-фазовой ВЭЖХ. Результаты, независимо определенные разными методами, согласуются между собой: их общее среднее S(Q) для нескольких образцов равно 7.1 ± 1.6 мг/л (pS = 4.63). Поскольку полученные результаты относятся к образцам Q, содержащим различные количества кристаллизационной и гидратной воды, то заключительной стадией определений является их экстраполяция на нулевое содержание воды в образцах. Обсуждается необходимость предварительного контроля содержания воды и органических примесей в образцах по данным элементного и ВЭЖХ анализа. Образцы кверцетина, как и других экстрактивных веществ растений, могут содержать примеси, искажающие результаты определения растворимости.
Ключевые слова: Кверцетин, растворимость в воде, зависимость от рН, зависимость от концентрации органического компонента раствора, экстраполяция, высокоэффективная жидкостная хроматография
Полный текст:
PDF (Russian)Литература
REFERENCES
Mabry T.J., Markham K.R., Thomas M.B. The Systematic Identification of Flavonoids. Springer-Verlag, New York, 1970. 354 p.
Read M.A. Flavonoids: naturally occurring anti-inflammatory agents. Amer. J. Pathol. 1995, vol. 147, no. 2, pp. 235-237.
Viktor A., David A.. Overviews of biologically importance of quercetin: a bioactive flavonoid. Pharmacogn. Rev. 2016, vol. 10, no. 20, pp. 84-89. doi: 19.4103/0973-7847.194044.
Borghetti G.S., Carini J.P., Honorato S.B., Ayala A.P., Moreira J.C.F., Bassani V.L. Phy¬sicochemical properties and thermal stability of quercetin hydrates in the solid state. Thermochim. Acta. 2014, vol. 539, pp. 109-114. doi: 10.1016/j.tca.2012.04.015.
Zenkevich I.G., Guschina S.V. Determination of dissociation constants of species oxidi¬zable in aqueous solutions by air oxygen on an example of quercetin. J. Analyt. Chem. (Russ.), 2010, vol. 65, no. 4. pp. 371-375. doi: 10.1134/S1061934810040064.
Kasikci M.B., Bagdatlioglu N. Bioavailability of quercetin. Curr. Res. Nutr. Food Sci., 2016, vol. 4, no. 2, pp. 146-151.
Althans D., Schader P., Enders S. Solubilisation of quercetin: comparison of hyperbran¬ched polymer and hydrogel. J. Mol. Liquids, 2014, vol. 196, pp. 86-93. doi: 10.1016/j.molliq.2014.03.028.
Abraham M.H., Acree W.E. On the solubility of quercetin. J. Mol. Liquids, 2014, vol. 197. pp. 157-159. doi: 10.1016/j.molliq.2014.05.006.
Pool H., Mendoza S., Xiao H., McClements D.J. Encapsulation and release of hydropho¬bic bioactive components in nanoemulsion-based delivery systems: impact of physical form on quercetin bioaccessibility. Food Func. 2013, vol. 4, pp. 162-174.
Srinivas K., King J.W., Howard L.R., Monrad J.K. Solubility and solution thermodyna¬mic properties of quercetin and quercetin dehydrate in subcritical water. J. Food Eng. 2010, Vol. 100, pp. 208-218. doi: 10.1016/j.jfoodeng.2010.04.001.
Lauro M.R., Torre M.L., Maggi L., De Simone F., Conte U., Aquino R.P. Fast- and slow-release tablets for oral administration of flavonoids: rutin and quercetin. Drug Devel. Ind. Pharm. 2002, Vol. 28, no. 4, pp. 371-379.
Chebil L., Chipot C., Archamboult F., Humeau C., Engasser J.M., Ghoul M., Dehez F. Solubilities inferred from the combination of experiment and simulation. Case study of quercetin in a variety of solvents. J. Phys. Chem. B., 2010, vol. 114, pp. 12308-12313. doi: 10.1021/jp.104596k.
Kim M.K., Park K.-S., YeoW.-S., Choo H., Chong Y. In vitro solubility and permea¬bi¬lity of novel quercetin-amino acid conjugates. Bioorg. Med. Chem. 2009, vol. 17, pp. 1164-1171. doi: 10.1016/j.bmc.2008.12.043.
DRUG BANK: https://www.drugbank.ca/drugs/DB04216 (дата обращения: август 2019 г.)
Razmara R.S., Daneshfar A., Sahraei R. Solubility of quercetin in water + methanol and water + ethanol from (292.8 to 333.8) K. J. Chem. Eng. Data. 2010, vol. 55, pp. 3934-3936. doi: 10.1021/je9010757.
Aguda R., Chen C.-C.. Solubility of nutraceutical compounds in generally recognized as safe solvents at 298 K. Int. J. Chem. Eng. Applic. 2016, vol. 7, no. 5, pp. 291-294. doi: 10.18178/ijcea.2016.7.5.591.
King J.W., Srinivas K. Measurement of aqueous solubility of compounds at high tem¬pe¬rature. Using a dynamic flow apparatus and a Teledyne Isco syringe pump. Teledyne Isco. Syringe Pump Application Note AN27, 2012. 7 p.
Ссылки
- На текущий момент ссылки отсутствуют.
