ПРОБОПОДГОТОВКА ПОЧВ И ДОННЫХ ОТЛОЖЕНИЙ С ИСПОЛЬЗОВАНИЕМ ТЕХНИКИ ЭКСТРАКЦИОННОГО ВЫМОРАЖИВАНИЯ ПРИ ХРОМАТОМАСС-СПЕКТРОМЕТРИЧЕСКОМ ОПРЕДЕЛЕНИИ ПАУ
Аннотация
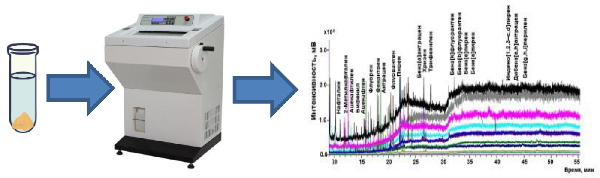
Объектами исследований были почвы (Имеретинская низменность, г. Сочи), торф (ООО «Гера», Россия), морские (Темрюкский залив Азовского моря) и речные донные отложения (Курчанский лиман, Темрюкский район), песок (о. Кайо Романо, Куба). С использованием техники экстракционного вымораживания под действием центробежных сил изучена возможность пробоподготовки исследуемых объектов для ГХ-МС-определения полициклических ароматических углеводородов. Оптимизированы условия экстракции аналитов смесью ацетонитрила с водой на образцах почв и донных отложений. Общий объем экстракционной смеси составил 10 мл при экстракционном вымораживании под действием центробежных сил при температуре морозильной камеры (-28 оС), скорости вращения ротора центрифуги 4000 об/мин для навески образца 1-2 г. «Легкие» ПАУ (нафталин, 2-метилнафталин, аценафтилен, бифенил, аценафтен, флуорен, фенантрен, антрацен, флуорантен и пирен) эффективно извлекались при 15 % ацетонитрила в экстракционной смеси с пределами их ГХ-МС-определения от 0.83 мкг/кг до 0.92 мкг/кг. Для одновременного ГХ-МС-определения 20 «легких» и «тяжелых» ПАУ, концентрация ацетонитрила в экстракционной смеси должна составлять не менее 50 %. В этих условиях степень извлечения из объектов анализа «легких» ПАУ варьировала от 83 % до 97 %, «тяжелых» – от 61 % до 92 %. Разработанная методика экспрессна, позволяет проводить извлечение аналитов и очистку экстрактов в одну стадию, а также определять ПАУ ниже установленных ПДК для изученных объектов исследования. Показатели эффективности извлечения и концентрирования ПАУ из почв и донных отложений с применением разработанной пробоподготовки сопоставили с известными альтернативными вариантами и получили удовлетворительную сходимость.
Ключевые слова: полициклические ароматические углеводороды, экстракционное вымораживание, почвы, донные отложения, хроматографический анализ
DOI: http://dx.doi.org/10.15826/analitika.2020.24.4.003 DOI: http://dx.doi.org/10.15826/analitika.2020.24.4.003 Z.A. Temerdashev 1, T.A. Chervonnaya 1, T.N. Musorina 1, V.N. Bekhterev 2 1 Kuban State University, ul. Stavropolskaia, 149, Krasnodar, 350040, Russian Federation 2 Sochi State University, ul. Plastunskaya, 94, Sochi,354000, Russian FederationПолный текст:
PDFЛитература
REFERENCES
Błaszczyk E., Mielżyńska-Švach D. Polycyclic aromatic hydrocarbons and PAH-related DNA adducts. Journal of Applied Genetics, 2017, vol.58, no.3, pp. 321-330. doi: 10.1007/s13353-016-0380-3.
Nesnow S., Davis C., Nelson G., Lambert G., Padgett W., Pimentel M., Tennant A. , Kligerman A., Ross J. Comparison of the genotoxic activities of the K-region dihydrodiol of benzo[a]pyrene with benzo[a]pyrene in mammalian cells: morphological cell transformation; DNA damage; and stable covalent DNA adducts. Mutation Research, 2002, vol. 521, no. 1-2, pp. 91-102. doi: 10.1016/s1383-5718(02)00218-8.
Baird W. M., Hooven L.A., Mahadevan B. Carcinogenic Polycyclic Aromatic Hydrocarbon-DNA adductsand mechanism of action. Environmental and Molecular Mutagenesis, 2005, vol. 45, no. 2-3, pp. 106-114. doi: 10.1002/em.20095.
Yan L.S. Study of the carcinogenic mechanism for polycyclic aromatic hydrocarbons — extended bay region theory and its quantitative model. Carcinogenesis, 1985, vol. 6, no. 1, pp. 1-6. doi: 10.1093/CARCIN/6.1.1.
Luo A., Wu Y.-R., Xu Y., Kan J., Qiao J., Liang L., Huang T., Hu Z. Characterization Fn of a cytochrome P450 monooxygenase capable of high molecular weight PAHs oxidization from Rhodococcus sp. P14. Process Biochemistry, 2016, vol. 51, no. 12, pp. 2127-2133. doi:10.1016/j.procbio.2016.07.024.
IARC, International Agency for Research on Cancer monographs on the evaluation of the carcinogenic risk of chemicals to human. Polynuclear aromatic compounds, Part I, Chemical, environmental, and experimental data. World Health Organization. Switzerland. Geneva, 1983, 477 p.
WHO report on the global tobacco epidemic, 2015: raising taxes on tobacco. World Health Organization. Switzerland. Geneva, 2015, 103 p.
ATSDR, Public Health Statement Polycyclic Aromatic Hydrocarbons (PAHs). Agency for Toxic Substances and Disease Registry, Department Of Health And Human Services. Public Health Service. Atlanta, 1995, 6 p.
Kameda T. Atmospheric chemistry of polycyclic aromatic hydrocarbons and related compounds. Journal of Health Science, 2011, vol. 57, no.6, pp. 504-511. doi:10.1248/jhs.57.504.
Angerer J., Mannschreck C., Gundel J. Biological Monitoring and Biochemical Effect Monitoring of Exposure to Polycyclic Aromatic Hydrocarbons. International Archives of Occupational and Environmental Health, 1997, vol.70, pp. 365-377. doi:10.1007/s004200050231.
Johnsena A.R., Wick L.Y., Harms H. Principles of microbial PAH-degradation in soil. Environmental Pollution, 2005, vol.133, no.1, pp. 71-84. doi:10.1016/j.envpol.2004.04.015.
Park K.S., Sims R.C., Dupont R.R. Transformation of PAHs in soil systems. Journal of Environmental Engineering, 1990, vol.116, no.3, pp. 632-640. doi: 10.1061/(asce)0733-9372(1990)116:3(632).
De Boer J., Law R.J. Developments in the use of chromatographic techniques in marine laboratories for the determination of halogenated contaminants and polycyclic aromatic hydrocarbons. Journal of Chromatography A, 2003, vol.1000, no.1-2, pp. 223-251. doi:10.1016/s0021-9673(03)00309-1.
Lee H.K. Modern techniques for the analysis of polycyclic aromatic hydrocarbons. Handbook of Analytical Separations, 2001, vol.3, pp. 39-74.
Brouwer E.R., Hermans A.N.J., Lingeman H., Brinkman U.A.Th. Determination of polycyclic aromatic hydrocarbons in surface water by column liquid chromatography with fluorescence detection, using on-line micelle-mediated sample preparation. Journal of Chromatography A, 1994, vol.669, no.1-2, pp. 45-57. doi: 10.1016/0021-9673(94)80335-8.
McDowall R.D. Sample preparation for biochemical analysis. Journal of Chromatography B: Biomedical Sciences and Applications, 1989, vol.492, pp. 3-58. doi:10.1016/S0378-4347(00)84463-1.
Banjoo D.R., Nelson P.K. Improved ultrasonic extraction procedure for the determination of polycyclic aromatic hydrocarbons in sediments. Journal of Chromatography A, 2005, vol.1066, no.1-2, pp. 9-18. doi: 10.1016/j.chroma.2005.01.033.
Filipkowska A., Lubecki L., Kowalewska G. Polycyclic aromatic hydrocarbon analysis in different matrices of the marine environment. Analytica Chimica Acta, 2005, vol.547, no.2, pp. 243-254. doi:10.1016/j.aca.2005.05.023.
Hassan J., Izadib M., Homayonnejad S. Application of Low Density Homogeneous Liquid-Liquid Extraction Combined with GC for TPH and PAH Determination in Semi-micro Solid Samples. Journal of the Brazilian Chemical Society, 2013, vol.24, no.4, pp. 639-644. doi:10.5935/0103-5053.20130080.
Tavakoli L., Yamini Y., Ebrahimzadeh H., Shariati S. Homogeneous liquid-liquid extraction for preconcentration of polycyclic aromatic hydrocarbons using a water/methanol/chloroform ternary component system. Journal of Chromatography A, 2008, vol. 1196-1197, pp. 133-138. doi: 10.1016/j.chroma.2008.04.036.
Zhu L., Shaoliang F. Synergistic solubilization of polycyclic aromatic hydrocarbons by mixed anionic–nonionic surfactants. Chemosphere, 2002, vol.53, no.5, pp. 459-467. doi:10.1016/s0045-6535(03)00541-1.
Tolmacheva N. G., Zhang M., Pirogov A., Popik M. V., Shpigun O. Application of microemulsions to the recovery, preconcentration, and determination of ten surfactants from various soils. Journal of Analytical Chemistry, 2017, vol. 72., no.7, pp. 602-607 doi: 10.1134/S1061934817060156.
Avino P., Notardonato I., Perugini L., Russo M. V. New protocol based on high-volume sampling followed by DLLME-GC-IT/MS for determining PAHs at ultra-trace levels in surface water samples. Microchemical Journal, 2017, vol.133, pp. 251-257. doi: 10.1016/j.microc.2017.03.052.
Leng G., Lui G., Chen Y., Yin H., Dan D. Vortex-assisted extraction combined with dispersive liquid–liquid microextraction for the determination of polycyclic aromatic hydrocarbons in sediment by high performance liquid chromatography. Journal of Separation Science, 2012, vol. 35, no. 20, pp. 2796-2804. doi:10.1002/jssc.201200234.
Zorn W.M. Method of making concentrated fruit juice. US Patent, US728111A, 1927.
Vieira H. P., Neves A. A., Queiroz M. E. L. R. Optimization and validation of liquid-liquid extraction with the low temperature partitiontechnique (LLE – LTP) for pyrethroids in water and GC analysis. Química Nova, 2007, vol. 30. no. 3, pp. 535-540. doi: 10.1590/s0100-40422007000300006.
Pinho G. P., Neves A. A., Queiroz M. E. L.R., Silvério F. O. Optimization of the liquid–liquid extraction method and low temperature purification (LLE – LTP) for pesticide residue analysis in honey samples by gas chromatography. Food Control, 2010, vol. 21, no. 10, pp. 1307-1311. doi: 10.1016/j.foodcont.2010.03.006.
Maslamani N., Manandhar E., Geremia D. K., Logue B.A. ICE Concentration Linked with Extractive Stirrer (ICECLES). Analytica Chimica Acta, 2016, vol. 941, pp. 41-48. doi:10.1016/j.aca.2016.09.003.
Yoshida M., Akane A. Subzero-temperature liquid-liquid extraction of benzodiazepines for high-performance liquid chromatography. Analytical Chemistry, 1999, vol. 71, no. 9, pp. 1918-1921. doi:10.1021/ac981276g.
Schneider G. M. Aqueous solutions at pressures up to 2 GPa: gas–gas equilibria, closed loops, high-pressure immiscibility, salt effects and related phenomena. Physical Chemistry Chemical Physics, 2002, vol. 4, no. 6, pp. 845-852. doi: 10.1039/b109277b.
Bekhterev V.N. Trends in the behavior of dissolved organic substances under the conditions of freeze extraction. Journal of Analytical Chemistry, 2011, vol. 66, no. 591, pp. 591-595. doi: 10.1134/s1061934811060025.
Shi Z., Li Z., Zhang S., Fu H., Zhang H. Subzero-Temperature Liquid–Liquid Extraction Coupled with UPLC–MS-MS for the Simultaneous Determination of 12 Bioactive Components in Traditional Chinese Medicine Gegen-Qinlian Decoction. Journal of Chromatographic Science, 2015, vol. 53, no. 8, pp. 1407-1413. doi: 10.1093/chromsci/bmu226.
Bekhterev V.N., Gavrilova S.N., Shipanov I.N. The use of extractive freezing-out at the stage of preliminary preparation of bioprobes in GC-MS chemico-toxicological analysis. SudMedEkspert, 2019, vol. 62, no. 6, pp. 53-57. doi: 10.17116/sudmed20196206153.
Temerdashev Z.A., Musorina T.N., Chervonnaya T.A. Determination of Polycyclic Aromatic Hydrocarbons in Soil and Bottom Sediments by Gas Chromatography–Mass Spectrometry Using Dispersive Liquid–Liquid Microextraction. Journal of Analytical Chemistry, 2020, vol. 75, pp. 1000-1010. doi: 10.1134/s1061934820080158.
Pavlenko L. F., Korpakova I. G., Eletskiy B. D., Skripnik G. V., Kurilov P. I., Votinova T. V., Anohina N. S., Korablina I. V. [Oil components and heavy metals in blowouts of Golubitsky mud volcano]. Zashchita okruzhaiushchei sredy v neftegazovom komplekse [Environmental protection in the oil and gas complex], 2017, vol.7, pp. 29-34 (in Russian)
Pavlenko L. F., Larin A. A., Skorokhod I. A., Korpakova I. G., Temerdashev Z. A. Specific features of establishing the component of composition oil pollution of the ecosystems of the Azov and Black Sea. Ekologicheskii vestnik nauchnykh tsentrov Chernomorskogo ekonomicheskogo sotrudnichestva [Ecological Bulletin of Scientific Centers of the Black Sea Economic Cooperation], 2012, vol. 9, no. 4, pp. 76-82 (in Russian)
Chervonnaia T.A., e.a. Sposob opredeleniia politsiklicheskikh aromaticheskikh uglevodorodov v pochvakh i donnykh otlozheniiakh [The way to determination polycyclic aromatic hydrocarbons in soils and bottom sediments]. Patent RF, no. 2019115408, 2019 (in Russian).
Rocha M. J., Rocha E., Cruzeiro C., Ferreira P. C., Reis P. A. Determination of Polycyclic Aromatic Hydrocarbons in Coastal Sediments from the Porto Region (Portugal) by Microwave-Assisted Extraction, Followed by SPME and GC–MS. Journal of Chromatographic Science, 2011, vol.49, no.9, pp. 695-701. doi.org/10.1093/chrsci/49.9.695
DOI: https://doi.org/10.15826/analitika.2020.24.4.003
Ссылки
- На текущий момент ссылки отсутствуют.
