ООПРЕДЕЛЕНИЕ ГОМОЦИСТЕИНА И ТИОЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ С СПОЛЬЗОВАНИЕМ ГЕТЕРОЦИКЛИЧЕСКИХ ДИСУЛЬФИДОВ
Аннотация
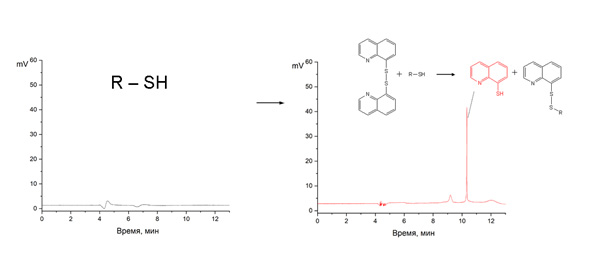
Биологически активные низкомолекулярные аминотиолы, такие как гомоцистеин, характеризуются малоинтенсивным поглощением в ультрафиолетовом и видимом диапазоне излучения, поэтому для их анализа в большинстве случаев применяют дериватизацию. Дериватизирующий агент взаимодействует с тиольной группой аналита с образованием соединения, интенсивно поглощающего в длинноволновой области спектра. В качестве дериватизирующих агентов часто применяются гетероциклические дисульфиды. Методики анализа с их использованием, как правило, отличаются простотой и точностью. Однако широко применяемые в аналитической практике дисульфиды, такие как дитиодипиридин и 5,5′-дитиобис-(2-нитробензойная кислота), имеют ряд недостатков, к числу которых относятся узкий диапазон значений pH, при которых дисульфиды могут быть использованы, а также низкая контрастность аналитической реакции. Поэтому поиск новых аналитических агентов продолжается. Для определения гомоцистеина использованы дисульфиды 2,2′-дитиобис[бензоксазол] и 8,8′-дитиобис[хинолин]. Изучена кинетика реакции между гомоцистеином и предложенными дисульфидами. Исследовано влияние pH на изменение оптической плотности в процессе протекания аналитической реакции. Разработаны точные и чувствительные методики определения гомоцистеина спектрофотометрическим методом, методами капиллярного электрофореза (КЭ), высокоэффективной жидкостной хроматографии (ВЭЖХ) и кинетическим методом со спектрофотометрическим детектированием (предел обнаружения гомоцистеина 1.1·10-6-7.8·10-6 М, относительное стандартное отклонение 1.5-4.6 %). Предложенные дисульфиды также были использованы при определении сульфгидрильных групп в образце человеческой урины. Результаты, полученные при использовании 2,2′-дитиобис[бензоксазола] и 8,8′-дитиобис[хинолина] и при использовании распространенного в аналитической практике 4,4′-дитиодипиридина, оказались близки, что указывает на применимость предложенных реагентов в анализе реальных объектов.
Ключевые слова: гомоцистеин, аминотиолы, 2,2′-дитиобис[бензоксазол], 8,8′-дитиобис[хинолин]
DOI: http://dx.doi.org/10.15826/analitika.2022.26.3.005Полный текст:
PDF (Russian)Литература
REFERENCES
Liu Y., Yu D., Ding S., Xiao Q., Guo J., Feng G. Rapid and ratiometric fluorescent detection of cysteine with high selectivity and sensitivity by a simple and readily available probe. ACS Appl. Mater. Interfaces., 2014, vol. 6, no. 20, pp. 17543–17550. https://doi.org/10.1021/am505501
Chen W., Luo H., Liu X., Foley J. W., Song X. Broadly Applicable strategy for the fluorescence based detection and differentiation of glutathione and cysteine/homocysteine: demonstration in vitro and in vivo. Anal. Chem., 2016, vol. 88, no. 7, pp. 3638–3646. https://doi.org/10.1021/acs.analchem.5b04333
Finkelstein J. D. The metabolism of homocysteine: pathways and regulation. Eur. J. Pediatr., 1998, vol. 157, no. 2. pp. 40-44. https://doi.org/10.1007/PL00014300
Hultberg B., Andersson A., Isaksson A. The cell-damaging effects of low amounts of homocysteine and copper ions in human cell line cultures are caused by oxidative stress. Toxicology, 1997, vol. 123, no. 1, pp. 33–40. https://doi.org/10.1016/S0300-483X(97)00105-4
Mulay S.V., Kim Y., Choi M., Lee D.Y., Choi J., Lee Y., Jon S., Churchill D.G. Enhanced doubly activated dual emission fluorescent probes for selective imaging of glutathione or cysteine in living systems. Anal. Chem., 2018, vol. 90, no. 4, pp. 2648–2654. https://doi.org/10.1021/acs.analchem.7b04375
Shcherbatykh A.A., Chernov’yants M.S. [Study of antithyroid and antioxidant properties of cysteine, glutathione, and methionine by spectrophotometry and high performance liquid chromatography]. J. Anal. Chem., 2021, vol. 76, no. 4, pp. 313–323. https://doi.org/10.31857/S0044450221040125.
Gao Q., Zhang W., Song B., Zhang R., Guo W., Yuan J. Development of a novel lysosome-targeted ruthenium(ii) complex for phosphorescence/time-gated luminescence assay of biothiols. Anal. Chem., 2017, vol. 89, no. 8, pp. 4517–4524. https://doi.org/10.1021/acs.analchem.6b04925
Schoentgen F., Metz-Boutique M.-H., Jollès J., Constans J., Jollès pp. Complete amino acid sequence of human vitamin D-binding protein (group-specific component): evidence of a three-fold internal homology as in serum albumin and α-fetoprotein. Biochim. Biophys. Acta., 1986, vol. 871, no. 2, pp. 189–198. https://doi.org/10.1016/0167-4838(86)90173-1
Flynn E. Pharmacokinetic Parameters. Elsevier, 2007. 656 p.
Peters T. All about albumin: Biochemistry, genetics, and medical applications. San Diego, Academic Press, 2007. 432 p.
Li Y., Duan Y., Li J., Zheng J., Yu H., Yang R. Simultaneous nucleophilic-substituted and electrostatic interactions for thermal switching of spiropyran: a new approach for rapid and selective colorimetric detection of thiol-containing amino acids. Anal. Chem., 2012, vol. 84, no. 11, pp. 4732–4738. https://doi.org/10.1021/ac203494e
Xu B., Zhou H., Mei Q., Tang W., Sun Y., Gao M., Zhang C., Deng S., Zhang Y. Real-time visualization of cysteine metabolism in living cells with ratiometric fluorescence probes. Anal. Chem., 2018, vol. 90, no. 4, pp. 2686–2691. https://doi.org/10.1021/acs.analchem.7b04493
Liang S.-C., Wang H., Zhang Z.-M., Zhang H.-S. Determination of thiol by high-performance liquid chromatography and fluorescence detection with 5-methyl-(2-(m-iodoacetylaminophenyl)benzoxazole. Anal. Bioanal. Chem., 2005, vol. 381. no. 5, pp. 1095–1100. https://doi.org/10.1007/s00216-004-3006-2
Glatz Z., Mašlaňová H. Specific thiol determination by micellar electrokinetic chromatography and on-column detection reaction with 2,2′-dipyridyldisulfide. J. Chromatogr. A., 2000, vol. 895, no. 1, pp. 179–187. https://doi.org/10.1016/S0021-9673(00)00475-1
Ševčíková P., Glatz Z. Specific determination of cysteine in human urine by capillary micellar electrokinetic chromatography. J. Sep. Sci., 2003, vol. 26, no. 8, pp. 734–738. https://doi.org/10.1002/jssc.200301372
Yoosefian J., Alizadeh N. An optical configuration of crossed-beam photothermal lens spectrometer operating at high flow velocities and its application for cysteine determination in human serum and saliva. Anal. Chem., 2018, vol. 90, no. 13, pp. 8227–8233. https://doi.org/10.1021/acs.analchem.8b01697
Ngamchuea K., Batchelor-McAuley C., Compton R.G. Rapid method for the quantification of reduced and oxidized glutathione in human plasma and saliva. Anal. Chem., 2017, vol. 89, no. 5, pp. 2901–2908. https://doi.org/10.1021/acs.analchem.6b04186
Petrova A.V., Moskvin L.N., Bulatov A.V., Ishimatsu R., Nakano K., Imato T., Vishnikin A.B. [Flow-injection spectrophotometric determination of cysteine in biologically active dietary supplements]. J. Anal. Chem., 2016, vol. 71, no. 2, pp. 178-184. https://doi.org/10.7868/S0044450216020122.
Okda H.E., El Sayed S., Ferreira R.C., Costa S.P., Raposo M.M., Martínez-Máñez R., Sancenón F. 4-(4,5-Diphenyl-1H-imidazole-2-yl)-N,N-dimethylaniline-Cu(II) complex, a highly selective probe for glutathione sensing in water-acetonitrile mixtures. Dyes and Pigments, 2018, vol. 159, pp. 45–48. https://doi.org/10.1016/j.dyepig.2018.05.069
Stachniuk J., Kubalczyk P., Furmaniak P., Głowacki R. A versatile method for analysis of saliva, plasma and urine for total thiols using HPLC with UV detection. Talanta, 2016, vol. 155, pp. 70–77. https://doi.org/10.1016/j.talanta.2016.04.031
Le Thuy P., Nyhan W.L. A screening method for cystine and homocystine in urine. Clin. Chim. Acta., 1992, vol. 211, no. 3, pp. 175–179. https://doi.org/10.1016/0009-8981(92)90193-T
Grassetti D.R., Murray J.F. Determination of sulfhydryl groups with 2,2′- or 4,4′-dithiodipyridine. Arch. Biochem. Biophys., 1967, vol. 119, pp. 41–49. https://doi.org/10.1016/0003-9861(67)90426-2
Hansen R.E., Østergaard H., Nørgaard P., Winther J.R. Quantification of protein thiols and dithiols in the picomolar range using sodium borohydride and 4,4'-dithiodipyridine. Anal. Biochem., 2007, vol. 363, no. 1, pp. 77–82. https://doi.org/10.1016/j.ab.2007.01.02
Riener C.K., Kada G., Gruber H.J. Quick measurement of protein sulfhydryls with Ellman's reagent and with 4,4'-dithiodipyridine. Anal. Bioanal. Chem., 2002, vol. 373, no. 4-5, pp. 266–276. https://doi.org/10.1007/s00216-002-1347-2
Robotham A.C., Kelly J.F. Detection and quantification of free sulfhydryls in monoclonal antibodies using maleimide labeling and mass spectrometry. mAbs, 2019, vol. 11, no. 4, pp. 757–766. https://doi.org/10.1080/19420862.2019.1595307
Ševčı́ková P., Glatz Z., Tomandl J. Determination of homocysteine in human plasma by micellar electrokinetic chromatography and in-capillary detection reaction with 2,2′-dipyridyl disulfide. J. Chromatogr. A., 2003, vol. 990, no. 1-2. pp. 197–204. https://doi.org/10.1016/S0021-9673(03)00048-7
Bellomo G., Thor H., Orrenius S. Modulation of cellular glutathione and protein thiol status during quinone metabolism. Methods Enzymol., 1990, vol. 186, pp. 627–635. https://doi.org/10.1016/0076-6879(90)86158-R
Chernov'yants M.S., Kolesnikova T.S., Karginova A.O. Thioamides as radical scavenging compounds: Methods for screening antioxidant activity and detection. Talanta, 2016, vol. 149, pp. 319–325. https://doi.org/10.1016/j.talanta.2015.11.069
Shcherbatykh A.A., Chernov'yants M.S., Popov L.D. Determination of low molecular thiols and protein sulfhydryl groups using heterocyclic disulfides. Amino acids, 2022, vol. 54, pp. 469–479. https://doi.org/10.1007/s00726-022-03132-w
Tian H., Yu Z., Hagfeldt A., Kloo L., Sun L. Organic redox couples and organic counter electrode for efficient organic dye-sensitized solar cells. J. Am. Chem. Soc., 2011, vol. 133, no. 24, pp. 9413–9422. https://doi.org/10.1021/ja2030933
Solyev P.N., Sherman D.K., Novikov R.A., Levina E.A., Kochetkov S.N. Hydrazo coupling: the efficient transition-metal-free C–H functionalization of 8-hydroxyquinoline and phenol through base catalysis. Green Chem., 2019, vol. 21, no. 23, pp. 6381–6389. https://doi.org/10.1039/c9gc02824b
DOI: https://doi.org/10.15826/analitika.2022.26.3.005
Ссылки
- На текущий момент ссылки отсутствуют.
