CПЕКТРОФОТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ФЕНИЛАЛАНИНА В ВОДНЫХ РАСТВОРАХ РАЗЛИЧНОЙ КИСЛОТНОСТИ
Аннотация
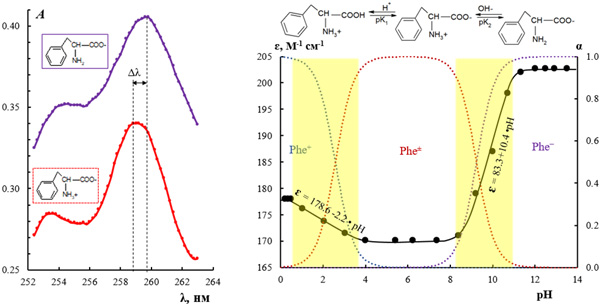
Разработан способ определения фенилаланина в водных растворах различной кислотности спектрофотометрическим методом без предварительной коррекции pH растворов и применения вспомогательных химических реагентов. Проведен сравнительный анализ результатов спектрофотометрического определения фенилаланина при варьировании кислотности среды, проанализированы погрешности и возможность их минимизации. Показано, что аналитический сигнал и результаты определения аминокислоты в растворах с различным pH значительно различаются вследствие нахождения фенилаланина в разных ионных формах, отличающихся величиной молярного коэффициента поглощения. Установлено, что максимальная величина молярного коэффициента поглощения падает в ряду ε(Phe-) > ε(Phe+) > ε(Phe±) на 20 %. Максимальная погрешность определения фенилаланина без учёта зависимости оптической плотности раствора от кислотности среды найдена в сильнощелочных растворах. Экспериментально получены корреляционные зависимости аналитической длины волны и молярного коэффициента поглощения фенилаланина от показателя pH среды. Установлен длинноволновый (батохромный) сдвиг максимума полосы поглощения при переходе от положительного к отрицательному заряду фенилаланина с ростом величины pH раствора. Выявлены два диапазона величин pH, в которых изменение кислотности растворов не вызывает спектральных изменений. Это область преимущественного нахождения аминокислоты в катионной Phe+ и биполярной Phe± формах (pH < 8) и область анионной Phe− (pH > 10) формы. Приведены регрессионные уравнения, позволяющие сделать выбор аналитической длины волны при любой произвольной величине pH раствора. Преимуществом разработанного способа определения аминокислоты без коррекции величины рН в растворах являются возможность повышения чувствительности и обеспечение относительной погрешности определения менее 0.5 % при коэффициенте вариации не более 0.3 %. Предел обнаружения аминокислоты, рассчитанный по 3s-критерию, составляет (1.4-1.6)·10-5 М. Диапазон определяемых содержаний фенилаланина находится в интервале (0.5-5.3)·10-3 М. Показана эффективность предложенного способа для определения фенилаланина в образце препарата "L-Фенилаланин" (Protein Company, Россия) методом добавок. Доказана возможность минимизации погрешности определения аминокислоты при применении разработанного способа для контроля содержания компонентов в процессе деминерализации водно-солевых растворов фенилаланина методом электродиализа с экспериментальными мембранами.
Ключевые слова: спектрофотометрия; фенилаланин; кислотность среды; спектры поглощения
Полный текст:
PDF (Russian)Литература
REFERENCES
Damian J.H. Biophysical characterization of proteins in developing biopharmaceuticals (2-ed.). USA, Elsevier, 2020. 586 p.
Monahova Yu.B., Chernova R.K., Varygina O.V. [Chemometric Method of PLS in the Treatment of Titrimetric Data when Opredeleniye of Arginine and Lysine in Mixed Solutions]. Izv. Sarat. un-ta. Nov. ser. Ser. Khimiia. Biologiia. Ekologiia [Izvestiya of Saratov University. New Ser. Ser. Chemistry. Biology. Ecology], 2017, vol. 17, no. 3, pp. 280–285. DOI: 10.18500/1816-9775-2017-17-3-280-285 (in Russian).
Majstrenko V.N., Il'jasova R.R., Kudasheva F.H., Sadretdinov M.A., Majstrenko T.V. [Quantitative analysis of α-amino acids in the urine of nervous surgical patients by thin layer chromatography on ArmSorb plates]. Vestnik Bashkirskogo universiteta [Bulletin of Bashkir University], 2008, vol. 13, no. 2, pp. 265–269 (in Russian).
Nashhekina Yu.A., Kurdyukova K.E., Zorin I.M., Mikhailova N.A., Bilibin A.Yu. Spectrophotometric evaluation of L-Lysine concentrations in water–organic solutions. Technical Physics, 2018, vol. 88, no. 9, pp. 1384–1386. DOI: 10.21883/JTF.2018.09.46425.31-18.
Antosiewicz J.M., Shugar D. UV–Vis spectroscopy of tyrosine side-groups in studies of protein structure. Biophys. Rev., 2016, vol. 8, pp. 163–177. DOI: 10.1007/s12551-016-0197-7
Abbaspour A., Ghaffarinejad A., Safaei E. Determination of l-histidine by modified carbon paste electrode using tetra-3,4 pyridinoporphirazinatocopper(II). Talanta, 2004, vol. 64, no. 4, pp. 1036–1040. DOI: 10.1016/j.talanta.2004.05.013
Amini M. K., Shahrokhian S., Tangestaninejad S. PVC-based Mn (III) porphyrin membrane-coated graphite electrode for determination of histidine. Anal. Chem., 1999, vol. 71, pp. 2502–2505. DOI: 10.1021/ac9812633
Parshina A.V., Titova T.S., Bobreshova O.V., Safronova E.Y., Yaroslavtsev A.B. Determination of glycine, alanine, and leucine at different solution pH with the aid of donnan potential sensors based on hybrid membranes. Journal of Analytical Chemistry, 2016, vol. 71, no. 3, pp. 259–268. DOI: 10.1134/S1061934816030102.
Fluorimetry. Pharmacopoeia of the Russian Federation. [Fluorimetriia. Farmakopeia Rossiiskoi Federatsii]. Available at: http://pharmacopoeia.ru/ofs-1-2-1-1-0006-15-fluorimetriya (accessed 1 September 2021) (in Russian).
Beketov V.I., Voronina R.D., Zorov N.B. Fluorimetric determination of amino acids and photochemical stability of their reaction products with ortho-phthalic aldehyde under irradiation by high-power pulsed laser. Moscow University Chemistry Bulletin, 2012, vol. 67, no. 4, pp. 149–153. DOI: 10.3103/S0027131412040013.
Głowacki R., Borowczyk K., Bald E., Jakubowski H. On-column derivatization with o-phthaldialdehyde for fast determination of homocysteine in human urine. Anal. Bioanal. Chem., 2010, vol. 396, no. 6, pp. 2363–2366. DOI: 10.1007/s00216-010-3456-7
Kand'ár R., Žáková P., Jirošová J., Sladká M. Determination of branched chain amino acids, methionine, phenylalanine, tyrosine and α-keto acids in plasma and dried blood samples using HPLC with fluorescence detection. Clin. Chem. Lab. Med., 2009, vol. 47, no. 5, pp. 565–572. DOI: 10.1515/CCLM.2009.123
Pozdeev V.K., Pozdeev N.V. [Determination of total aminothiols and neuroactive amino acids in plasma by high performance liquid chromatography with fluorescence detection]. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 2010, vol. 4, no. 3, pp. 288–295. DOI: 10.1134/S199075081003011X.
Douša M., Břicháč J., Gibala P., Lehnert P. Rapid hydrophilic interaction chromatography determination of lysine in pharmaceutical preparations with fluorescence detection after postcolumn derivatization with o-phtaldialdehyde. J. Pharm. Biomed. Anal., 2011, vol. 54, no. 5, pp. 972–978. DOI: 10.1016/j.jpba.2010.11.026
Kőrös Á., Varga Z.S., Molnár-Perl I. Simultaneous analysis of amino acids and amines as their o-phthalaldehyde-ethanethiol-9-fluorenylmethyl chloroformate derivatives in cheese by high-performance liquid chromatography. J. Chromatogr. A., 1999, vol. 47, no 5, pp. 146–152. DOI: 10.1016/j.chroma.2008.07.035
Zuman P. Reactions of orthophthalaldehyde with nucleophiles. Chemical reviews, 2004, vol. 104, no. 7, pp. 3217–3238. DOI: 10.1021/cr0304424
Kubota K., Mizukoshi T., Miyano H. A new approach for quantitative analysis of L-phenylalanine using a novel semi-sandwich immunometric assay. Anal. Bioanal. Chem., 2013, vol. 405, no. 25, pp. 8093–8103. DOI: 10.1007/s00216-013-7081-0
Soga T., Heiger D. N. Amino acid analysis by capillary electrophoresis electrospray ionization mass spectrometry. Anal. Chem., 2000, vol. 72, № 6, pp. 1236–1241. DOI: 10.1021/ac990976y
GOST R 55569–2013. Korma, kombikorma, kombikormovoe syr'e. Opredelenie proteinogennyh aminokislot metodom kapilljarnogo jelektroforeza [State Standard R 55569–2013. Feed, compound feed, compound feed raw materials. Determination of proteinogenic amino acids by capillary electrophoresis]. Moscow, Standartinform Publ., 2013. 25 p. (in Russian).
GOST R 52347–2005. Kombikorma, kombikormovoe syr'e. Opredelenie soderzhaniia aminokislot (lizina, metionina, treonina, tsistina i triptofana) metodom kapilliarnogo elektroforeza [State Standard R 52347–2005. Compound feed, compound feed raw materials. Determination of amino acid content (lysine, methionine, threonine, cystine and tryptophan) by capillary electrophoresis]. Moscow, Standartinform Publ., 2005. 25 p. (in Russian).
Selemenev V.F., Hohlov V.Ju., Korenman N.Ja., Lovchinskaja E.V. [Spectrophotometric determination of phenylalanine and tyrosine]. Journal of Analytical Chemistry, 1994, vol. 49, no. 4, pp. 446–447 (in Russian).
Kaznacheev A.V., Khokhlova O.N., Selemenev V.F., Khokhlov V.Yu., Mokshina N.Ya. Spectrophotometric determination of aromatic and heterocyclic amino acids in mixtures. Journal of Analytical Chemistry, 2000, vol. 55, no. 4, pp. 335–337. DOI: 10.1007/BF02757767
Mokshina N.Ya., Savushkin R.V., Selemenev V.F., Hohlov V.Ju. [Determination of ascorbic acid and amino acids by method of UV-spectroscopy]. Analitika i Kontrol [Analytics and control], 2004, vol. 8, no. 4, pp. 346–348.
Davydova E.G., Kotova D.L., Krysanova T.A. Selemenev V.F. Spectrophotometric determination of proline in aqueous solutions. Journal of Analytical Chemistry, 2005, vol. 60, no. 8, pp. 710–713. DOI: 10.1007/s10809-005-0167-x
Mokshina N.Ya., Korenman Ya.I., Pahomova O.A., Zykov A.V. [Separate determination of the aromatic α - amino acids and vitamins after extraction from water environments]. Analitika i Kontrol [Analytics and control], 2009, vol. 13, no. 4, pp. 169–173 (in Russian).
Lindon J.C. Encyclopedia of spectroscopy and spectrometry (3-ed). United Kingdom, Elsevier, 2017. 502 p.
Demchenko A.P. Ultraviolet spectroscopy of proteins. Berlin Heidelberg, Springer-Verlag, 1986. 312 p.
Kazicyna L.A., Kupletskaja N.B. Primenenie UF-, IK-, JaMR i mass-spektroskopii v organicheskoi khimii [Application of UV, IR, NMR and mass spectroscopy in organic chemistry]. Moscow, Moscow State University Publ., 1979. 240 p. (in Russian).
Kotova D.L., Krysanova T.A., Eliseeva T.V. Spektrofotometricheskoe opredelenie aminokislot v vodnykh rastvorakh [Spectrophotometric determination of amino acids in aqueous solutions]. Voronezh, Voronezh State University Publ., 2004. 55 p. (in Russian).
Fitz J., Mammana A. Spectroscopic study of the pH dependent interaction of an achiral molecular photo-switch with poly-Glutamic acid. J. Photochem. Photobiol, A., 2020. vol. 338. pp. 112146. DOI: 10.1016/j.jphotochem.2019.112146
Krysanova T.A., Kotova D.L., Vasil'eva S.Yu., Slashheva E.A., Rjazhskih Yu.Yu., Erina O.V. [Spectrophotometric determination sodium salt of Cefotaxime in aqueous solution]. Vestnik VGU. Seriia: Khimiia. Biologiia. Farmatsiia [Proceedings of Voronezh State University. Series: Chemistry. Biology. Pharmacy], 2015, vol. 18, no. 2, pp. 13–16. (in Russian).
Lavrinenko I.A., Holyavka M.G., Chernov V.E., Artyukhov V.G. Second derivative analysis of synthesized spectra for resolution and identification of overlapped absorption bands of amino acid residues in proteins: Bromelain and ficin spectra in the 240-320 nm range. Spectrochim. Acta, Part A, 2020, vol. 227, pp. 117722. DOI: 10.1016/j.saa.2019.117722
Selemenev V.F., Hohlov, V.Ju., Bobreshova O.V., Aristov I.V., Kotova D.L. Fiziko-himicheskie osnovy sorbcionnykh i membrannykh metodov vydeleniia i razdeleniia aminokislot [Physicochemical foundations of sorption and membrane methods for the isolation and separation of amino acids]. Voronezh, Voronezh State University Publ., 2001. 300 p. (in Russian).
Smagunova A.N., Karpukova O.M. Metody matematicheskoi statistiki v analiticheskoi khimii [Methods of mathematical statistics in analytical chemistry]. Rostov n/D, Feniks Publ., 2012. 346 p. (in Russian).
Doerfel' K. Statistika v analiticheskoj khimii [Statistics in analytical chemistry]. Moscow, Mir Publ., 1994. 267 p. (in Russian).
Griffith E.C., Vaida V. Ionization state of l‑phenylalanine at the air−water interface, J. Am. Chem. Soc., 2013. vol. 135, no. 2, pp. 710–716. DOI: 10.1021/ja308089n
Khokhlova O.N. [Some features of the thermodynamics of non-exchange sorption of phenylalanine by anion exchangers of various nature]. Zhurnal fizicheskoi khimii [Russian Journal of Physical Chemistry], 2010, vol. 84, no. 5, pp. 753–759 (in Russian).
Goleva E.A., Vasil'eva V.I., Abramova E.O., Saud Ali Munir, Kostylev D.V., Smagin M.A. [Rheological and spectral properties of aqueous solutions of phenylalanine ]. Sorbtsionnye i khromatograficheskie protsessy [Sorption and chromatographic processes], 2018, vol. 18, no. 2, pp. 190–196. DOI: 10.17308/sorpchrom.2018.18/499 (in Russian).
Vasil'eva V.I., Goleva E.A., Selemenev V.F. Features of the sorption of phenylalanine by profiled ion-exchange membranes, J. Phys. Chem. A, 2013. vol .90, no. 10, pp. 2035–2043. DOI: 10.1134/S0036024416100277
Karlashova T.S., Trunaeva E.S., Khohlova O.N., Khohlov V.Yu. [Non-exchange sorption of phenylalanine by low-basic anion exchangers from hydrochloric acid solutions]. Sorbtsionnye i khromatograficheskie protsessy [Sorption and chromatographic processes], 2014, vol. 14, no. 4, pp. 648–653 (in Russian).
Vorob'ev M.M., Baranov A.A., Belikov V.M. Investigation of hydration of α - amino acids by absorption millimeter spectroscopy. Izvestiia Akademii Nauk - Seriia Khimicheskaia [Russian Chemical Bulletin], 1996, no. 3, pp. 618–623.
Prasad S., Mandal I., Singh S., Paul A., Mandal B., Venkatramani R., Swaminathan R. Near UV-Visible electronic absorption originating from charged amino acids in a monomeric protein, Chem. Sci., 2017. vol. 8, no. 8, pp. 5416–5436. DOI: 10.1039/C7SC00880E
Fadeeva V. I., Barbalat Ju.A., Shehovcova T.N., Ivanov V.M. Osnovy analiticheskoi khimii. Prakticheskoe rukovodstvo [Fundamentals of analytical chemistry. Practical Guide]. Moscow, Vysshaja shkola Publ, 2001. 464 p. (in Russian).
DOI: https://doi.org/10.15826/analitika.2022.26.3.003
Ссылки
- На текущий момент ссылки отсутствуют.
