Сравнительная характеристика различных вариантов электрофоретического определения моно- и дисахаридов с применением дериватизации
Аннотация
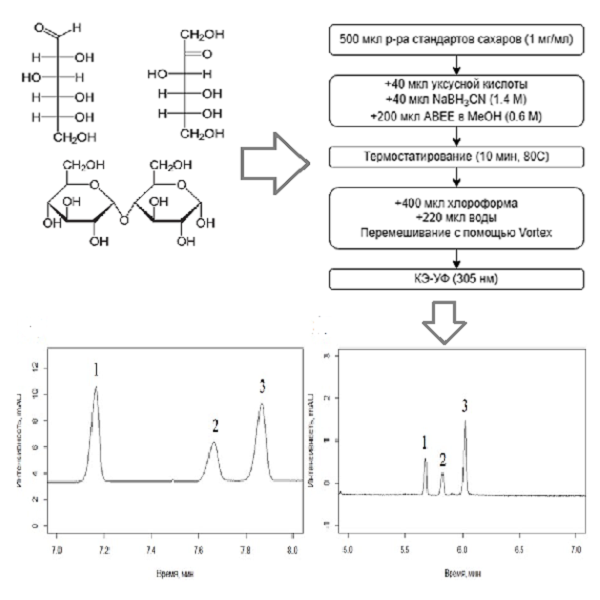
В работе рассмотрены следующие варианты электрофоретического определения сахаров с предварительной дериватизацией: восстановительное аминирование этиловым эфиром п-аминобензойной кислоты (ЭАБ) и конденсация с 1-фенил-3-метил-5-пиразолоном (ФМП). Разделение производных проводили как в мицеллярном, так и в зонном режимах (КЗЭ) капиллярного электрофореза (КЭ) с получением сравнительных оценочных характеристик. Лучшие значения эффективности (~ 650 тыс. теоретических тарелок), факторов разрешения (2.1 – 2.4) и пределов обнаружения (ПО) (0.8 – 2.9 мкг/мл) обнаружены для восстановительного аминирования с последующим определением в условиях мицеллярной электрокинетической хроматографии (МЭКХ). Условия дериватизации восстановительным аминированием оптимизированы с использованием центрального композитного дизайна эксперимента. Выявлены дополнительные резервы снижения ПО за счет внутрикапиллярного концентрирования в режиме свипинга (факторы концентрирования 13 – 19). Показана принципиальная возможность внутрикапиллярного восстановительного аминирования с обеспечением электрофоретической подвижности реагента дериватизации за счет введения в раствор мицелл поверхностно-активных веществ (ПАВ). Оба подхода с применением дериватизации апробированы на образцах детского питания.
Ключевые слова: капиллярный электрофорез, углеводы, дериватизация, восстановительное аминирование, внутрикапиллярное концентрирование.
Полный текст:
PDFЛитература
REFERENCES
Clemente-Suárez V.J., Mielgo-Ayuso J., Martín-Rodríguez A., Ramos-Campo, L. Redondo-Flórez D.J., Tornero-Aguilera J.F. The Burden of Carbohydrates in Health and Disease. Nutrients, 2022, vol. 14, no. 18, article 3809. doi:10.3390/nu14183809.
Yki-Järvinen H., Luukkonen P.K., Hodson L., Moore J.B. Dietary carbohydrates and fats in nonalcoholic fatty liver disease. Nat. Rev. Gastroenterol. Hepatol, 2021, vol. 18, no. 11, pp. 770-786. doi:10.1038/s41575-021-00472-y.
McCleary B.V., McLoughlin C., Charmier L.M.J., McGeough P. Measurement of available carbohydrates, digestible, and resistant starch in food ingredients and products. Cereal Chem., 2020, vol. 97, no. 1, pp. 114-137. doi:10.1002/cche.10208.
Bolshakov D.S., Amelin V.G. Capillary electrophoresis in assessing the quality and safety of foods. J. Anal. Chem., 2023, vol. 78, no. 7, pp. 815-855. doi:10.1134/s106193482307002x.
Jie L., Yuan Z., Yu Z., Xue-Song F. Progress in the pretreatment and analysis of carbohydrates in food: An update since 2013. J. Chromatogr. A, 2021, vol. 1655, article 462496. doi:10.1016/j.chroma.2021.462496.
Kartsova L.A., Maliushevska A.V., Kolobova E.A. Analytical Capabilities of the Determination of Carbohydrates by Chromatographic and Electrophoretic Methods. J. Anal. Chem., 2023, vol. 78, no. 2, pp. 144-161. doi:10.1134/S1061934823020041.
Kurzyna-Szklarek M., Cybulska J., Zdunek A. Analysis of the chemical composition of natural carbohydrates – an overview of methods. Food Chem., 2022, vol. 394, article 133466. doi:10.1016/j.foodchem.2022.133466.
Mantovani V., Galeotti F., Maccari F., Volpi N. Recent advances in capillary electrophoresis separation of monosaccharides, oligosaccharides, and polysaccharides. Electrophoresis, 2017, vol. 39, no. 1, pp. 179-189. doi:10.1002/elps.201700290.
Kolobova E.A., Maliushevska A.V., Kartsova L.A. Electrophoretic Determination of Carbohydrates in Samples of Natural Origin by an Indirect Detection Method. J. Anal. Chem., 2024, vol. 79, no. 2, pp. 224-232. doi:10.1134/S1061934824020102.
Smolkova D., Cmelik R., Lavicka J. Labeling strategies for analysis of oligosaccharides and glycans by capillary electrophoresis. Trends Anal. Chem., 2023, vol. 163, article. 117068. doi:10.1016/j.trac.2023.117068.
Guček M., Pihlar B. Capillary electrochromatography of 1-phenyl-3-methyl-5-pyrazolone derivatives of some mono-and disaccharides. Chromatographia, 2000, vol. 51, no. 1, pp. S139-S142. doi:10.1007/BF02492796.
Honda S., Suzuki S., Taga A. Analysis of carbohydrates as 1-phenyl-3-methyl-5-pyrazolone derivatives by capillary/microchip electrophoresis and capillary electrochromatography. J. Pharm. Biomed. Anal., 2003, vol. 30, no. 6, pp. 1689-1714. doi:10.1016/S0731-7085(02)00512-5.
Taga A., Suzuki S., Honda S. Capillary electrophoretic analysis of carbohydrates derivatized by in-capillary condensation with 1-phenyl-3-methyl-5-pyrazolone. J. Chromatogr. A, 2001, vol. 911, no. 2, pp. 259-267. doi:10.1016/S0021-9673(01)00516-7.
Wang W., Chen F., Zheng F., Russell B.T. Optimization of synthesis of carbohydrates and 1-phenyl-3-methyl-5-pyrazolone (PMP) by response surface methodology (RSM) for improved carbohydrate detection. Food Chem., 2020, vol. 309, article 125686. doi:10.1016/j.foodchem.2019.125686.
Blanco D., Muro D., Gutiérrez M.D. A comparison of pulsed amperometric detection and spectrophotometric detection of carbohydrates in cider brandy by liquid chromatography. Anal. Chim. Acta, 2004, vol. 517, no. 1, pp. 65-70. doi:10.1016/j.aca.2004.04.056.
Kwon H., Kim J. High Performance Liquid Chromatography of Mono- and Oligosaccharides Derivatized with P-Aminobenzoic Ethyl Ester on a C18-Bonded Silica Column. J. Liq. Chromatogr., 1995, vol. 18, no. 7, pp. 1437-1449. doi:10.1080/10826079508010422.
Nguyen D.T., Lerch H., Zemann A., Bonn G. Separation of derivatized carbohydrates by co-electroosmotic capillary electrophoresis. Chromatographia, 1997, vol. 46, no. 3, pp. 113-121. doi:10.1007/BF02495320.
Molnár-Gábor D., Lengyel M., Krongaard T. Rapid method for quantitation of seven human milk oligosaccharides in infant formula and premix. Carbohyd. Res., 2024, vol. 541, article 109149. doi:10.1016/j.carres.2024.109149.
Sjöberg J., Adorjan I., Rosenau T., Kosma P. An optimized CZE method for analysis of mono- and oligomeric aldose mixtures. Carbohyd. Res., 2004, vol. 339, no. 11, pp. 2037-2043. doi:10.1016/j.carres.2004.06.003.
Čokrtová K., Mareš V., Křížek T. On-capillary fluorescent labeling of saccharides for capillary electrophoresis. Electrophoresis, 2023, vol. 44, no. 1-2, pp. 35-43. doi:10.1002/elps.202200136.
Lenth R.V. Response-Surface Methods in R, Using rsm. J. Stat. Softw., 2010, vol. 32, pp. 1-17. doi:10.18637/jss.v032.i07.
Kuhn M. Desirability package (2018). Available at: https://github.com/topepo/desirability (accessed April 3, 2024).
Blanco D., Muro D., Mangas J. Determination of monosaccharides in cider by reversed-phase liquid chromatography. Anal. Chim. Acta, 2001, vol. 436, no. 1, pp. 173-180. doi:10.1016/S0003-2670(01)00889-3.
DOI: https://doi.org/10.15826/analitika.2024.28.2.003
Ссылки
- На текущий момент ссылки отсутствуют.
