ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ СЕНСОР НА ОСНОВЕ АМИНОКИСЛОТНОГО КОМПЛЕКСА МЕДИ (II) ДЛЯ ОПРЕДЕЛЕНИЯ ЭНАНТИОМЕРОВ ТРИПТОФАНА
Аннотация
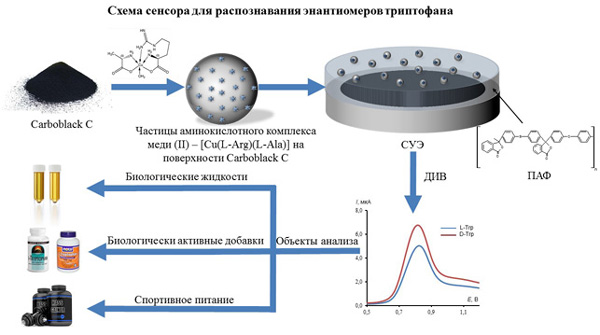
Разработан вольтамперометрический сенсор на основе композита полиариленфталида (ПАФ) и графитированной сажи Carboblack C, модифицированной хелатными комплексами L-аргенато-L-аланинат меди (II), для распознавания и селективного определения энантиомеров триптофана (Трп). Оптимизированы условия модифицирования сенсора, рассчитана площадь эффективной поверхности (А = 4.38 ± 0.06 мм2) и сопротивление переноса электрона (Ret= 1.29 ± 0.08 кОм). Подобраны оптимальные условия регистрации вольтамперограмм энантиомеров Трп: диапазон рабочих потенциалов 0.5-1.2 В, скорость сканирования потенциала 20 мВ/с, время выдерживания электрода в исследуемом растворе 5 с. Изучены электрохимические и аналитические характеристики сенсора при регистрации дифференциально-импульсных вольтамперограмм (ДИВ) энантиомеров Трп. Показано, что зависимость аналитического сигнала от концентрации L-Трп и D-Трп линейна в диапазоне от 1.25·10-6 до 1.00·10-3 М с пределами обнаружения (ПО) 0.90·10-6 М для L-Трп и 0.66·10-6 М для D-Трп. Наибольшую чувствительность разработанный сенсор проявляет к D-Трп. Сенсор успешно апробирован для определения содержания L- и D-Трп в растворах энантиомеров в присутствии вспомогательных веществ, входящих в состав лекарственных препаратов и биологически активных добавок. Предложенный сенсор позволяет проводить определения энантиомеров Трп в моче и плазме крови человека. Для оценки правильности определения D- и L-Трп использован метод "введено-найдено". При определении энантиомеров Трп в модельных растворах (n = 5; P = 0.95) относительное стандартное отклонение не превышает 2.3 %, а относительная погрешность – 1.7 %. При определении D- и L-Трп в биологических жидкостях (n = 5; P = 0.95) относительное стандартное отклонение колеблется в пределах 0.3-1.7 %, а относительная погрешность в пределах 0.3-5.6 %. Результаты исследований показывают отсутствие значимой систематической погрешности.
Ключевые слова: вольтамперометрия, модифицированные электроды, энантиомеры, аминокислоты, триптофан, полиариленфталид, биологически активные добавки, спортивное питание
Полный текст:
PDF (Russian)Литература
REFERENCES
Lahiri P., Dhaware D., Singh A., Panchagnula V., Ghosh D. Quantitation of Neurotoxic Metabolites of the Kynurenine Pathway by Laser Desorption Ionization Mass Spectrometry (LDI-MS). Metabolomics., 2019, vol. 1996, pp. 113-129. DOI: 10.1007/978-1-4939-9488-5_11
Gorina A.S., Kulinskiy V.I., Kolesnichenko L.S., Mikhnovich V.I. [Changes in the content of tryptophan and its metabolites in children with early childhood autism]. Название журнала транскрипцией [Bulletin of the SB RAMS], 2010, vol. 30. no 5, pp. 19-24 (in Russian).
Lanser L., Kink P., Egger E. M., Willenbacher W., Fuchs D., Weiss G., Kurz K. Inflammation-Induced Tryptophan Breakdown is Related With Anemia, Fatigue, and Depression in Cancer. Front. Immunol., 2020, vol. 11, pp. 249-270. DOI: 10.3389/fimmu.2020.00249
Pichler R., Fritz J., Heidegger I., Steiner E., Culig Z., Klocker H., Fuchs D. Predictive and prognostic role of serum neopterin and tryptophan breakdown in prostate cancer. Cancer Sci., 2017, vol. 108, pp. 663–670. DOI: 10.1111/cas.13171
Venkateswaran N., Lafita-Navarro M.C., Hao Y.H., Kilgore J., Perez-Castro L., Braverman J, Borenstein-Auerbach N., Kim M., Lesner N.P., Mishra P., Brabletz T., Shay J., DeBerardinis R., Williams N., Yilmaz O., Conacci-Sorrell M. MYC promotes tryptophan uptake and metabolism by the kynurenine pathway in colon cancer. Genes Dev., 2019, vol. 33, pp. 1236–1251. DOI: 10.1101/gad.327056.119
Opitz C.A., Wick W., Steinman L., Platten M. Tryptophan degradation in autoimmune disease. J. Cell. Mol. Life Sci., 2007, vol. 64, pp. 2542–2563. DOI:10.1007/s00018-007-7140-9
Giovannoni F., Li Z., Garcia C.C., Quintana F.J. A potential role for AHR in SARS-CoV-2 pathology. Res. Sq., 2020, vol. 3, pp. 25639. DOI: 10.21203/rs.3.rs-25639/v1
Zhang X., Chu H., Wen L., Shuai H., Yang D., Wang Y., Hou Y., Zhu Z., Yuan S., Yin F., Chan J.F.W., Yuen K.Y. Competing endogenous RNA network profiling reveals novel host dependency factors required for MERS-CoV propagation. Emerg. Microb. Infect,. 2020, vol. 9, pp. 733–746. DOI: 10.1080/22221751.2020.1738277
Thomas T., Stefanoni D., Reisz J.A., Nemkov T., Bertolone L., Francis R.O., Hudson K.E., ZimringJ.C., Hansen K.C., Hod E.A., Spitalnik,S .L., D’Alessandro A. COVID-19 infection alters kynurenine and fatty acid metabolism, correlating with IL-6 levels and renal status. JCI Insight., 2020, vol. 5, no. 14, pp. e140327. DOI: 10.1172/jci.insight.140327
Getsina M.L., Chernevskaya E.A., Beloborodova N.V. [The role of tryptophan metabolites common for humans and microbiota in severe diseases and critical conditions (review)]. [Clinical practice], 2020, vol. 11, no. 1, pp. 92-102. (in Russian) Clinical practice, 2020, vol. 11, no. 1, pp. 92-102. DOI: https://doi.org/10.17816/clinpract19068.
Labuta J., Ishihara S., Šikorský T., Futera Z., Shundo A., Hanykova L., Burda J.V., Ariga K., Hill J. PNMR spectroscopic detection of chirality and enantiopurity in referenced systems without formation of diastereomers. Nat. Commun., 2013, vol. 4, pp. 2188-2195. DOI: 10.1038/ncomms3188
Li M., Liu X., Jiang F., Guo L., Yang L. Enantioselective open-tubular capillary electrochromatography using cyclodextrin-modified gold nanoparticles as stationary phase. J. Chromatogr. A., 2011, vol. 1218, pp. 3725-3729. DOI: 10.1016/j.chroma.2011.04.045
Zhen Q., Xu B., Ma L., Tian G., Tang X., Ding M. Simultaneous determination of tryptophan, kynurenine and 5- hydroxytryptamine by HPLC: application in uremic patients undergoing hemodialysis. Clin. Biochem., 2011, vol. 44, pp. 226-230. DOI: 10.1016/j.clinbiochem.2010.10.011
Zhang T., Holder E., Franco P., Lindner W. Method development and optimization on cinchona and chiral sulfonic acid-based zwitterionic stationary phases for enantiomer separations of free amino acids by high-performance liquid chromatography. J. Chromatogr. A,. ., 2014, vol. 1363, pp. 191-199. DOI: 10.1016/j.chroma.2014.06.012
Taujenis L., Olsauskaite V., Padarauskas A. Enantioselective determination of protein amino acids in fertilizers by liquid chromatography-tandem mass spectrometry on chiral teicoplanin stationary phase. J. Agric. Food Chem., 2014, vol. 62, pp. 11099-11108. DOI: 10.1021/jf5047333
Iizuka H., Ishii K., Hirasa Y., Kubo K., Fukushima T. Fluorescence determination of D- and L-tryptophan concentrations in rat plasma following administration of tryptophan enantiomers using HPLC with pre-column derivatization. J. Chromatogr. B., 2011, vol. 879, pp. 3208-3213. DOI: 10.1016/j.jchromb.2011.02.014
Wei Y., Wang S., Shuang S., Dong C. Chiral discrimination between D - and L-tryptophan based on the alteration of the fluorescence lifetimes by the chiral additives. Talanta., 2010, vol. 81, pp. 1800-1805. DOI: 10.1016/j.talanta.2010.03.044
Maistrenko V.N., Evtyugin G.A., Zilberg R.A. Enantioselektivnye vol’tamperometricheskie sensory [Enantioselective voltammetric sensors]. Ufa, Izdatel’stvovo BashGU, 2018. 188 p. (in Russian).
Maistrenko V. N., Zilberg R. A. Enantioselective voltammetric sensors on the basis of chiral materials. J. Anal. Chem., 2020, vol. 75, no. 12, pp. 1514-1526. DOI: 10.1134/S1061934820120102
Niu X., Yang X., Li H., Liu J., Liu Z., Wang K. Application of chiral materials in electrochemical sensors. Microchim. Acta., 2020, vol. 187, pp. 1-18. DOI:10.1007/s00604-020-04646-4
Maistrenko V. N., Sidelnikov A.V., Zilberg R. A. Enantioselective voltammetric sensors: new solutions. J. Anal. Chem., 2018. vol. 73, no. 1, pp. 1-9. DOI: 10.1134/S1061934818010057
Yang X., Niu X., Mo Z., Guo R., Liu N., Zhao P., Liu Z. Perylene-functionalized graphene sheets modified with chitosan for voltammetric discrimination of tryptophan enantiomers. Microchim. Acta., 2019, vol.186, no. 6, pp. 333-345. DOI: 10.1007/s00604-019-3442-5
Suna Y.X., Hea J.H., Zhang D.D., Sheng Y., Xu D., Zhang R., Bradley M. Synergistic effects of chitosan and DNA self-assembly films on the chiral discrimination of tryptophan enantiomers. Microchem. J., 2021, vol. 165, pp. 106118. DOI:10.1016/j.microc.2021.106118
Zilberg R.A., Maistrenko V.N., Yarkaeva Yu.A., Dubrovskii D.I. An Enantioselective Voltammetric Sensor System Based on Glassy Carbon Electrodes Modified by Polyarylenephthalide Composites with α-, β, and γ-Cyclodextrins for Recognizing D- and L-Tryptophans. J. Anal. Chem., 2019, vol. 74, no. 12, pp. 1245–1255. DOI:10.1134/s1061934819110133
Qian J., Yi Y., Zhang D., Zhu G. Electrochemical recognition of tryptophan enantiomers using a multi-walled carbon nanotube@polydopamine composite loaded with copper (II). Microchim. Acta., 2019, vol. 186, no. 6, pp. 358-366. DOI: 10.1007/s00604-019-3469-7
Gou H., He J., Mo Z., Wei X., Hu R., Wang Y., Guo R. A Highly Effective Electrochemical Chiral Sensor of Tryptophan Enantiomers Based on Covalently Functionalize Reduced Graphene Oxide with L-Lysine. J. Electrochem. Soc., 2016, vol. 163, no. 7, pp. B272-B279. DOI: 10.1149/2.0361607jes
Kingsford O.J., Zhang D., Ma Y., Wu Y., Zhu G. Electrochemically Recognizing Tryptophan Enantiomers based on Carbon Black/Poly-l-Cysteine Modified Electrode. J. Electrochem. Soc., 2019, vol. 166, no. 13, pp. B1226–B1231. DOI: 10.1149/2.0791913jes
Zilberg R. A., Zagitogva L. R., Yarkaeva Yu. A., Maistrenko V. N. Composite sensors based on glass-carbon electrodes modified with amino acid complexes of transition metals for selective recognition and determination of enantiomers of biologically active substances. Molecular and biological aspects of chemistry, pharmacy and pharmacology. Collection of abstracts of the Sixth Interdisciplinary Conference. Edited by K. V. Kudryavtsev and E. M. Panina, Moscow, 2020. (in Russian).
Berestova T.V., Khursan S.L., Mustafin A.G. Experimental and theoretical substantiation of differences of geometric isomers of copper(II) α-amino acid chelates in ATR-FTIR spectra. Spectrochim. Acta A., 2020, vol. 229, no. 117950. DOI: 10.1016/j.saa.2019.117950
Zou J, Yu J.G. Nafion-stabilized black phosphorus nanosheetsmaltosyl-β-cyclodextrin as a chiral sensor for tryptophan enantiomers. Mater. Sci. Eng. C., 2020, vol. 112, pp. 110910. DOI: 10.1016/j.msec.2020.110910
Zilberg R.A., Karimova G.R., Terenteva A.S., Teres Yu.B., Yarkaeva Yu. A., Maistrenko V. N. [Voltammetric determination of tyrosine enantiomers in pharmaceutical and biological samples]. Vestn. Bashk. Univ., 2021, vol. 26, no. 1, pp. 84-92. DOI: 10.33184/bulletin-bsu-2021.1.14 (in Russian)
Dubrovsky D.I., Kabirova L.R., Khabletdinova A.I., Zilerg R.A., Maistrenko V.N [Voltammetric sensors based on composites of the polyelectrolyte complex of chitosan and α -, β, and γ-cyclodextrins for the determination and recognition of methionine enantiomers]. Vestn. Bashk. Univ., 2018, vol. 23, no. 3, pp. 721-727. (in Russian).
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarkaeva Yu.A., Khamitov E.M., Maksutova E.I., Kornilov V.M. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid. Electroanalysis, 2018, vol. 30, no. 4, pp. 619-625. DOI: 10.1002/elan.201700404
Zilberg R.A., Maistrenko V.N., Kabirova L.R., Dubrovsky D.I. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for the recognition and determination of atenolol enantiomers. Anal. Methods, 2018, vol. 10, no. 16, pp. 1886-1894. DOI: 10.1039/c8ay00403j
Kabirova L.R., Dubrovsky D.I., Nikonova N.A., Zilberg R.A., Maistrenko V.N. [Chemometric approaches in the treatment of tyrosine enantiomers voltammograms]. Doklady Bashkirskogo universiteta [Reports of the Bashkir University], 2019, vol. 4, no. 4, pp. 369-372. DOI: 10.33184/dokbsu-2019.4.1 (in Russian).
Sidelnikov A.V., Maistrenko V.N., Zilberg R.A., Yarkaeva Y.A., Khamitov E.M. Enantioselective voltammetric sensor for recognition of propranolol stereoisomers. J. Anal. Chem., 2017, vol. 72, no. 5, pp. 575-581. DOI: 10.1134/S1061934817050112
Zagitova L.R., Maistrenko V.N., Yarkaeva Y.A., Zagitov V.V., Zilberg R.A., Kovyazin P.V., Parfenova L.V. Novel chiral voltammetric sensor for tryptophan enantiomers based on 3-neomenthylindene as recognition element. J. Electroanal. Chem., 2021, vol. 880, p. 114939. DOI: 10.1016/J.JELECHEM.2020.114939
Chen Q, Zhou J, Han Q, Wang Y, Fu Y. Electrochemical enantioselective recognition of tryptophane enantiomers based on chiral ligand exchange. Colloids Surf. B, 2012, vol. 92, pp.130-135. DOI: 10.1016/j.colsurfb.2011.11.031
Li Z., Mo Z., Guo R., Meng S., Wang R., Gao H., Niu X. Electrochemical enantiorecognition of tryptophan enantiomers based on a multi-walled carbon nanotube–hydroxyethyl chitosan composite film. Anal. Methods, 2017, vol. 9, no. 35, pp. 5149–5155. DOI:10.1039/C7AY01775H
Xu J., Wang Q., Xuan C., Xia Q., Lin X., Fu Y. Chiral recognition of tryptophan enantiomers based on β -cyclodextrin-platinum nanoparticles/graphene nanohybrids modified electrode. Electroanalysis, 2016, vol. 28, pp. 868-873 DOI:10.1002/elan.201500548
Yarkaeva Yu.A., Islamuratova E.N., Zagitova L.R., Guskov V.Yu., Zilberg R.A., Maistrenko V.N. [Sensor for recognition and determination of tryptophan enantiomers based on a carbon-paste electrode modified by enantiomorphic bromotriphenylmethane crystals]. J. Anal. Chem., 2021, vol. 76, no. 11 (in print) (in Russian). DOI: 10.31857/S0044450221110177
DOI: https://doi.org/10.15826/analitika.2021.25.3.006
Ссылки
- На текущий момент ссылки отсутствуют.
